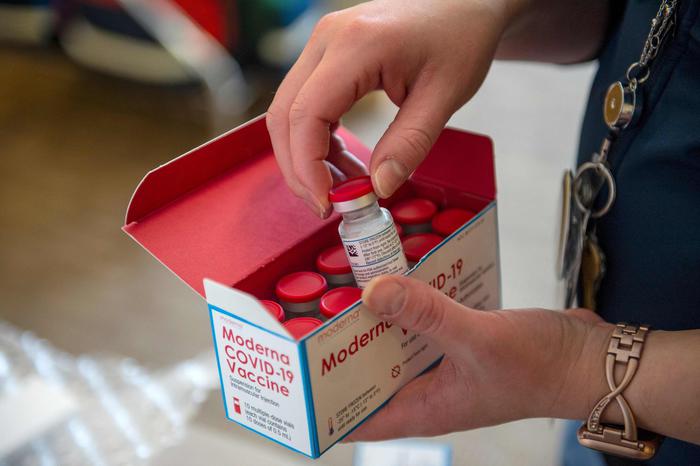
After the approval by the European Medicines Agency (EMA) of the Moderna vaccine, the Scientific Technical Commission of AIFA will meet on Thursday 7 January 2021 to examine the dossier on marketing authorization in Italy and define how to use it in the NHS.
La società è attiva nell’ambito della ricerca e lo sviluppo di farmaci basati sull’RNA messaggero (mRNA).
Il 16 novembre 2020 l’azienda ha annunciato la scoperta di mRNA-1273, un vaccino a RNA per far fronte alla pandemia di COVID-19 del 2019-2021, per il quale ha dichiarato un’efficacia del 94,5%, lo 0,5% in meno rispetto al vaccino di BioNTech e Pfizer, rispetto al quale, però, è di più facile conservabilità.
La molecola di mRNA è solitamente contenuta in un mezzo per la somministrazione di farmaci, come le nanoparticelle lipidiche, per proteggere i fragili filamenti di mRNA e favorire la loro entrata nelle cellule umane. La fragilità della molecola di mRNA richiede una distribuzione nella catena del freddo e conservazione a bassa temperatura, e può compromettere l’efficacia effettiva a causa di dosaggi inadeguati. Il vaccino Moderna però rimane stabile a temperature standard di refrigerazione tra 2 e 8 gradi C per 30 giorni. Inoltre, si prevedono condizioni di trasporto e conservazione a lungo termine a temperature standard del congelatore di -20 gradi C per 6 mesi
The mRNA-1273 delivery system utilizes a lipid nanoparticle drug delivery system.
Moderna relies on external companies and organizations operating under license to increase vaccine production: it has entered into a contract with Lonza Group for the production of the vaccine at the Portsmouth facilities in the USA and Visp, Switzerland. For the filling and packaging of the vials, Moderna has contracts with Catalent in the United States and Laboratorios Farmacéuticos Rovi in Spain.
Il 18 dicembre 2020, mRNA-1273 ha ricevuto l’autorizzazione per l’uso in casi emergenzali dalla Food and Drug Administration degli Stati Uniti. In seguito ne è stato autorizzato l’uso in Canada dal 23 dicembre 2020.
A fine 2020 Moderna ha ottenuto degli accordi di acquisto del suo vaccino con l’Unione Europea per 160 milioni di dosi e con il Canada per un massimo di 56 milioni di dosi. Complessivamente, nei prossimi tre mesi, giungeranno in Italia 1,3 milioni di dosi Moderna, con cadenza settimanale: 100mila a gennaio, 600mila a febbraio e 600mila a marzo.
Il 6 gennaio 2021 è stato autorizzato al commercio in Europa dall’Agenzia europea per i medicinali.
Related news: EMA. COVID-19 Vaccine Modern
EMA recommends COVID-19 Vaccine Moderna for authorization in the EU
AIFA. Press release no. 623 [0.14Mb] >