Differenze macroscopiche di prezzo tra i due farmaci oftalmici. La Francia vuole imitare l’Italia e l’Associazione industrie farmaceutiche chiama in causa la Ue. La questione dei costi sanitari e quella della sicurezza dei pazienti. Nuove indicazioni terapeutiche
di MAURIZIO PAGANELLI 10 luglio 2014 – La Repubblica.it Salute
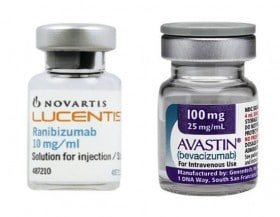
DIVENTA un caso europeo la vicenda del farmaco per la degenerazione maculare senile Lucentis (costo 902 euro, ma effettivo con gli sconti di circa 600 euro a fiala) e della sua “alternativa” 10 o 30 volte più economica,Avastin, un anti-cancro usato off-label, cioè fuori dalla sue specifiche indicazioni terapeutiche e non autorizzato per uso oftalmico: dopo la maxi multa dell’Antitrust italiano (180 milioni di euro, appena pagati dalle due aziende Novartis e Roche per evitare di pagare interessi, in attesa delle decisive sentenze Tar a fine anno), la Francia ha votato mercoledì all’Assemblea Nazionale, con 272 voti contro 234, un emendamento socialista per permettere l’uso del prodotto a minor costo. Ora si attende il voto del Senato, ma saranno possibili, in caso di approvazione, ricorsi alla Corte Costituzionale. La norma porterebbe un risparmio di circa 200 milioni l’anno nel budget sanitario francese. E già si prefigura un effetto domino in Europa, visti i problemi economici dei vari Paesi e dei rispettivi budget sanitari.
Regole stravolte. L’Efpia, Federazione europea delle industrie e associazioni farmaceutiche, ha immediatamente reagito ieri con una presa di posizione di Richard Bergström, direttore generale Efpia: “In tutta Europa si sta attualmente diffondendo una tendenza preoccupante, secondo la quale i governi ignorano importanti principi di tutela sanitaria e prendono decisioni sulla salute pubblica basate esclusivamente su considerazioni economiche a breve termine. Questa tendenza è una violazione sostanziale del quadro regolatorio, che invece è stato creato proprio per mantenere in Europa i più elevati standard di sicurezza dei pazienti”. E rilancia la questione a livello di Commissione europea: «Si tratta di un grave problema di salute pubblica, che la Commissione europea deve affrontare con urgenza. Gli Stati membri non devono creare autorizzazioni all’immissione in commercio (AIC) secondarie, a livello nazionale, per ragioni che minano il quadro regolatorio dell’Unione europea e che potrebbero potenzialmente mettere i pazienti a rischio, a fronte di vantaggi economici solo a breve termine”.
Questione di costi. A fronte di una “richiesta danni” alle farmaceutiche da parte del ministero della Salute di circa 45 milioni nel 2012, 540 milioni nel 2013 e 615 milioni nel 2014, i dati delle aziende, basati su fonti ufficiali (bollettino Osmed) indicano che «la spesa generata da Lucentis a carico del SSN nel periodo gennaio-settembre 2013 è stata pari a 38,6 milioni di euro, in linea con i dati registrati nel 2012 (51,2 milioni)». Alla recentissima assemblea di Farmindustria il vice ministro alla Sviluppo economico, Claudio De Vincenti, si è lasciato sfuggire che la questione Lucentis-Avastin e la conseguente multa dell’Antitrust non si sarebbe neppure posta “se la differenza tra i due prezzi non fosse stata così macroscopica”, e rilanciando, con il ministro della Salute, sulla necessità di una riforma dell’Aifa, l’Agenzia del farmaco, tanto da renderla più autorevole ed efficiente. Ma anche negli Stati Uniti l’aspetto economico sembra non essere sottovalutato: uno studio pubblicato a fine giugno dal British Medical Journal (Micheal McCarthy) parla di decine di miliardi di dollari “potenzialmente” risparmiati se i medici dei circa due milioni di americani affetti da degenerazione maculare ed edema maculare diabetico facessero ricorso al meno costoso dei due farmaci.
Farmaci sicuri? Il Lucentis è un “frammento di anticorpo umanizzato” per lo specifico trattamento di patologie oculari. È un anti-Vegf, come l’antitumorale Avastin, cioè blocca il fattore di crescita dell’endotelio vascolare, ma è stato studiato e testato per le patologie oculari. Novartis, produttrice del farmaco, ne fa una questione di informazioni “scientificamente corrette” ma spesso con conclusioni opposte a quanto afferma la Soi, la Società Oftalmologica Italiana che con il suo presidente Matteo Piovella ha ingaggiato la battaglia contro le autorità del farmaco italiano, Aifa, e i due colossi farmaceutici. L’azienda svizzera (come Roche di cui ha un pacchetto azionario di minoranza) ha voluto riproporre la propria autodifesa dalla sede centrale di Basilea, nell’ambito della presentazione delle nuove molecole allo studio (“Innovating for patients”). L’approccio, è stato detto da Tim Wright, capo globale della sviluppo, è “centrato sul paziente”: entro il 2018 previste 33 nuove molecole, 29 nuove indicazioni su specifiche patologie, 2 nuove formulazioni. Dalle malattie rare alla malaria, dal tumore alla psoriasi alla stessa maculopatia (Fovista in combinazione con Lucentis, previsto nel 2016). Fare sperimentazione su larga scala su una patologia specifica ha un costo ed è questione di sicurezza per i pazienti. Così è per Lucentis, hanno sottolineatoo i responsabili dell’azienda italiana, tra cui Elisa Muscianisi, area Oftamologia: “Avastin è un antitumorale con struttura diversa, entra in circolo nel corpo umano, non è stato studiato per un uso limitato, restando nell’occhio come Lucentis”. Si parla di sicurezza “sistemica” e di mancanza di un programma di farmacovigilanza per far emergere le segnalazioni. Avastin non ha confezioni “a misura di singola terapia intraoculare”, il farmaco è in un flacone. Proprio per ragioni di sicurezza il Consiglio Superiore di Sanità e l’Aifa hanno comunque stabilito che solo le farmacie ospedaliere potranno fare le preparazioni per le terapie intravitreali (iniezioni nell’occhio), prevedendo un sistema di monitoraggio. La Soi ha sempre replicato di avere linee guida e protocolli ottimizzati per l’uso corretto di Avastin: il medico oculista nei 3 anni di cura “monitora” meglio di chiunque altro il paziente, “tra visite, iniezioni e controlli, un totale di 81 contatti in tre anni!”. Sull’equivalenza dei due prodotti, inoltre, si sono in questi anni succeduti studi sulle riviste scientifiche più autorevoli.
Nuova indicazione terapeutica. Da ieri Lucentis è rimborsato dal Servizio Sanitario Nazionale anche per le persone affette da diminuzione visiva causata da neovascolarizzazione coroideale secondaria a miopia patologica (mCNV). Attualmente è quindi autorizzato (in cento Paesi) e rimborsato (in Italia) per cinque patologie retiniche: degenerazione maculare neovascolare legata all’età (AMD), diminuzione visiva causata da edema maculare diabetico (DME) e da occlusione venosa retinica sia centrale (CRVO) sia di branca (BRVO), e, come detto da ieri, neovascolarizzazione coroideale secondaria a miopia patologica (mCNV). La Società di oftalmologia Soi ha da tempo sostenuto che “fuori da ogni logica scientifica, l’Agenzia del farmaco (Aifa) limita ora l’applicazione di Avastin alla sola terapia della maculopatia senile”. In questo modo, esclude tutti i pazienti diabetici (che sono la maggioranza) e i giovani miopi: tanto per fare degli esempi”. La battaglia continua, aspettando le udienze al Tar del prossimo novembre.
AD