I dieci candidati farmaci da tenere sott’occhio nel 2022
Fierce Biotech ha stilato un elenco delle terapie in via di sviluppo più promettenti che potrebbero raggiungere risultati importanti nel 2022. Dall’Alzheimer all’ipertensione, ma anche osteoartrite e virus sinciziale per citare alcune delle patologie target
 Quali saranno le novità del settore farmaceutico nel 2022? Fierce Biotech prova a stilare il consueto elenco con quelle che a parere della redazione saranno le dieci novità più importanti del nuovo anno. Di sicuro come scrivono gli autori, si tratta di un ritorno al vecchio business, dopo un anno dedicato a farmaci e vaccini anti-Covid19. A riprendersi la scena saranno le malattie croniche che gravano pesantemente sulla salute pubblica, tra cui cancro, disturbi del sistema nervoso centrale, malattie cardiovascolari e artrite e infine malattie rare.
Quali saranno le novità del settore farmaceutico nel 2022? Fierce Biotech prova a stilare il consueto elenco con quelle che a parere della redazione saranno le dieci novità più importanti del nuovo anno. Di sicuro come scrivono gli autori, si tratta di un ritorno al vecchio business, dopo un anno dedicato a farmaci e vaccini anti-Covid19. A riprendersi la scena saranno le malattie croniche che gravano pesantemente sulla salute pubblica, tra cui cancro, disturbi del sistema nervoso centrale, malattie cardiovascolari e artrite e infine malattie rare.
Nell’elenco non sono inclusi solo nuovi potenziali farmaci, ma anche composti già in uso che potrebbero essere autorizzati per altre indicazioni. Nuove tecnologie come CRISPR, l’interferenza RNAi e la terapia genica sono i trattamenti prevalenti nella lista dei promettenti candidati farmaci per il 2022.
1. I farmaci mirati all’amiloide di Lilly e Roche per il morbo di Alzheimer
Dopo la delusione di aducanumab, farmaco sviluppato da Biogen e Eisai per il trattamento dell’Alzheimer che ha ricevuto un parere negativo da parte di Ema, il 2022 sarà l’anno di Eli Lilly e Roche. La prima ci prova con donanemad, candidato farmaco di cui ha presentato domanda di approvazione sulla base di dati di fase 2, utilizzando la clearance delle placche amiloidi come marker surrogato per l’efficacia clinica. Lilly spera nell’approvazione del farmaco alla fine del 2022 e sta conducendo contemporaneamente uno studio di conferma di fase 3 e uno studio di prevenzione. Anche e probabilmente dovrà fare i conti con gli stessi ostacoli che devono affrontare Biogen e il farmaco di Eisai.
Roche invece sta anche conducendo uno studio di fase 3 per il suo farmaco gantenerumab che ha come target anch’esso l’amiloide. I dati dovrebbero arrivare nella seconda metà del 2022. Gantenerumab ha fallito i test di fase 3 alcuni anni fa, ma è stato resuscitato con una dose più elevata che secondo Roche potrebbe aumentare la sua efficacia nell’eliminare l’amiloide. Il gruppo svizzero sta anche parlando della via di somministrazione sottocutanea di gantenerumab, che consentirebbe ai pazienti di somministrare il farmaco a casa, rispetto ad aducanumab somministrato per via endovenosa. L’endpoint primario di questi studi è la cognizione, un ostacolo più difficile da superare rispetto alla sola eliminazione dell’amiloide. Se i dati fossero positivi perciò potrebbero consentire a Roche di scavalcare la concorrenza.
Biogen ed Eisai, inoltre hanno avviato una domanda di marketing continuativa per il nuovo farmaco alla FDA statunitense, per un altro farmaco: lecanemab. I due partner hanno presentato i dati di fase 2 nel 2018 e hanno collegato la molecola a una riduzione dose-dipendente delle placche amiloidi e a un rallentamento del declino cognitivo. C’è anche uno studio di fase 3 in corso, con risultati previsti per settembre 2022.
2. CTX001 di Vertex e CRISPR Therapeutics
Dovrebbe essere depositata nel 2022 la domanda di autorizzazione di CRISPR Therapeutics e Vertex per la loro terapia genica (CTX001) one-shot per l’anemia falciforme (SCD) e la beta talassemia. Al momento hanno completato gli studi di fase 1/2 su CTX001 e stanno aspettando la chiusura del periodo di follow-up prima di finalizzare i risultati.
CTX001 è una terapia genica ex vivo che si basa sull’uso dell’editing genico CRISPR/Cas9 per modificare le cellule staminali ematopoietiche di un paziente in modo che generino globuli rossi con alti livelli di emoglobina fetale per sostituire le versioni difettose osservate nella talassemia e nella SCD. Restano alcune questioni aperte. Sull’efficacia perché non è ancora noto se la durata degli effetti di CTX001 siano tali da poterla considerare una terapia curativa. E sulla sicurezza, perché sono stati osservati alcuni eventi avversi con il trattamento, sebbene questi siano stati principalmente collegati alla terapia distruttiva del midollo osseo necessaria prima che la terapia genica possa essere somministrata.
3. Terapie geniche per la distrofia muscolare di Duchenne di Pfizer, Sarepta e Solid
Sono tre le aziende in corsa nel 2022 per lo sviluppo di una terapia genica per la distrofia muscolare di Duchenne (Dmd): Pfizer, Sarepta e Solid Bio. La Dmd è una malattia rara e incurabile che colpisce principalmente i giovani ragazzi ed è causata da mutazioni nel gene Dmd che riducono la produzione di una proteina chiamata distrofina, portando alla degenerazione muscolare progressiva. Le aziende stanno tutte lavorando su terapie geniche per aumentare la produzione di distrofina.
Pfizer è stata la prima a portare il suo candidato fordadistrogene movaparvovec (PF-06939926) ai test di fase 3, ma è stata costretta a rafforzare i suoi criteri di iscrizione dopo che sono stati segnalati tre casi di debolezza muscolare, inclusa l’infiammazione del tessuto cardiaco o miocardite e altri effetti collaterali. Al momento i pazienti arruolati si trovano in Europa e in Asia, poiché la FDA non ha autorizzato Pfizer a iniziare a trattare i pazienti statunitensi. La speranza dell’azienda è che i primi dati arrivino comunque prima della fine del 2022.
Sarepta, nel frattempo, sta conducendo una sperimentazione di fase 3 EMBARK del suo candidato, SRP-9001, che è iniziata nel mese di ottobre. L’azienda inoltre sta aspettando la seconda tornata di dati dal suo studio di fase intermedia, che ha mancato l’endpoint primario all’inizio del 2021. La terapia genica ha mostrato una tendenza verso il miglioramento della capacità di camminare nei pazienti con Dmd, ma non era statisticamente significativa. Se i dati in arrivo fossero positivi, potrebbe anche aumentare la possibilità di depositare anticipatamente la domanda di autorizzazione presso la Fda.
Solid Bio infine è in corsa con SGT-001, leggermente indietro rispetto ai suoi due rivali. Lo studio di fase 1/2 di quest’anno ha mostrato risultati intermedi deludenti e il trial è stato ritardato nel 2019 quando la Fda ha istituito una sospensione clinica a causa degli effetti collaterali del fegato e delle piastrine. All’inizio del 2022 dovrebbero arrivare nuovi dati sui primi tre pazienti trattati con una versione più recente SGT-001che dovrebbe ridurre il rischio di effetti collaterali.
4. LNA043 di Novartis per l’osteoartrite
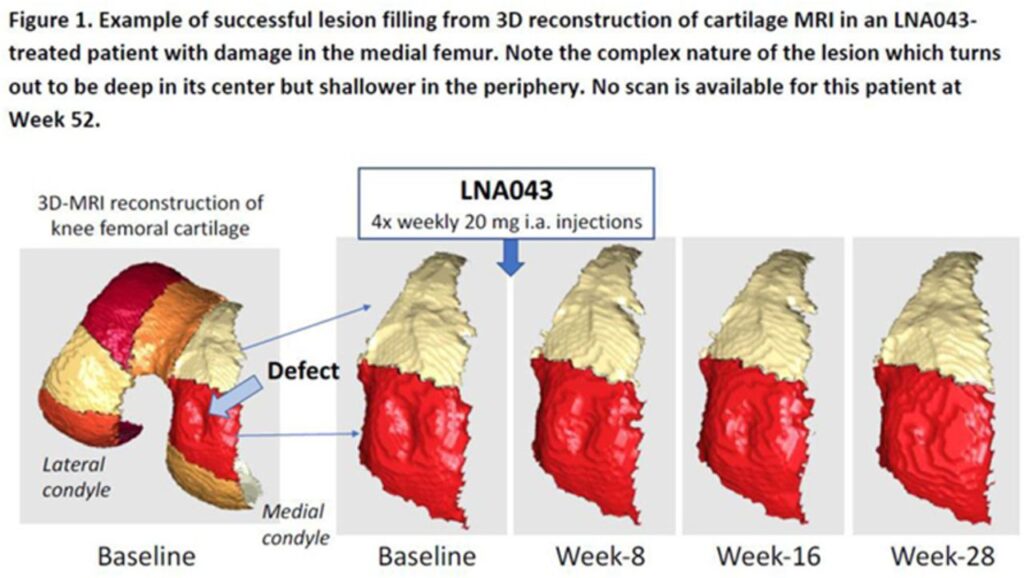 Un nuovo farmaco, l’agonista dell’angiopoietina 3 (ANGPTL3) LNA043 sviluppato da Novartis è ora in uno studio di fase 2b. I primi risultati dovrebbero arrivare entro la fine del 2022, anche se il follow-up non sarà completato fino al 2024. Se avrà successo, potrebbe rappresentare la prima terapia farmacologica per l’osteoartrite che affronta il danno cartilagineo sottostante che si verifica nella malattia.
Un nuovo farmaco, l’agonista dell’angiopoietina 3 (ANGPTL3) LNA043 sviluppato da Novartis è ora in uno studio di fase 2b. I primi risultati dovrebbero arrivare entro la fine del 2022, anche se il follow-up non sarà completato fino al 2024. Se avrà successo, potrebbe rappresentare la prima terapia farmacologica per l’osteoartrite che affronta il danno cartilagineo sottostante che si verifica nella malattia.
LNA043, che è stato sviluppato dagli Istituti Novartis per la ricerca biomedica (NIBR), è una versione modificata e ricombinante dell’ANGPTL3 umano che spinge le cellule delle articolazioni a rigenerare la cartilagine. Viene somministrato per iniezione direttamente nell’articolazione interessata.
Ricerche precedenti hanno dimostrato che una singola iniezione può stimolare la formazione di tessuto ialino-simile e, in uno studio di prova di fase 1, c’erano prove di rigenerazione della cartilagine danneggiata in pazienti con osteoartrite del ginocchio.
Se i risultati degli studi in fase avanzata sono positivi, Novartis potrebbe offrire ai pazienti un farmaco per contrastare quello che è stato descritto come “nichilismo terapeutico” nell’osteoartrite, o l’idea che sia una parte inevitabile dell’invecchiamento senza trattamenti efficaci oltre agli antidolorifici. Il farmaco a settembre ha ricevuto una designazione rapida dalla FDA.
5. Milvexian di Bristol Myers Squibb
A novembre, Bristol Myers Squibb e il partner Johnson & Johnson hanno riportato i primi dati proof-of-concept per milvexian, un follow-up dell’anticoagulante blockbuster Eliquis (apixaban) di BMS che è in procinto di diventare il primo inibitore orale del fattore XIa sul mercato. Il loro obiettivo è portare sul mercato un nuovo anticoagulante in grado di eguagliare l’efficacia dei farmaci mirati al fattore Xa come Eliquis e Xarelto di J&J/Bayer (rivaroxaban), ma eludere l’elevato rischio di effetti collaterali di sanguinamento che possono limitare l’uso di fluidificanti del sangue.
I risultati dello studio AXIOMATIC-TKR hanno mostrato che potrebbero essere sulla buona strada per avere successo. Milvexian (noto anche come BMS-986177), ha prevenuto il tromboembolismo venoso (TEV) – coaguli di sangue – nelle persone che hanno subito un intervento chirurgico di sostituzione totale del ginocchio, senza aumentare il rischio di sanguinamento. I dati sono stati presentati al congresso dell’American Heart Association (AHA) di quest’anno e pubblicati contemporaneamente sul New England Journal of Medicine.
Ora, tutti gli occhi sono puntati su AXIOMATIC-SSP, un secondo studio intermedio che sta esaminando il potenziale del milvexian nella prevenzione di ictus secondari in persone che hanno subito un ictus o un attacco ischemico transitorio, noto anche come “mini-ictus”.
Questa potrebbe essere un’altra importante indicazione per Eliquis, che BMS vende insieme a Pfizer, e il set di dati collettivo di entrambi gli studi sarà necessario per portare il milvexian nella fase 3. AXIOMATIC-SSP dovrebbe fornire risultati nella prima metà del 2022.
6. Icenticaftor di Novartis per la Bpco
Icenticaftor (noto anche come QWB251) è indicato per la broncopneumopatia cronica ostruttiva (BPCO con un nuovo meccanismo d’azione che colpisce al cuore della loro malattia. A momento la Bpco è trattato con broncodilatatori e corticosteroidi, ma c’è un urgente bisogno di farmaci alternativi, più efficaci e più sicuri che vadano oltre il trattamento dei sintomi e affrontino anche il processo patologico sottostante e, idealmente, prevengano la progressione inversa della BPCO. Se lo sviluppo andasse secondo i piani, Icenticaftor potrebbe diventare una terapia di successo da 2 miliardi di dollari all’anno.
Icenticaftor è un potenziatore oralmente attivo del regolatore della conduttanza transmembrana della fibrosi cistica (CFTR), ed è stato inizialmente testato come trattamento per la fibrosi cistica, una malattia genetica caratterizzata da un eccesso di muco nei polmoni che non può essere eliminato efficacemente e porta a infezioni croniche e infiammazioni. Novartis sta riproponendo icenticaftor come farmaco per la BPCO, basandosi sulla logica che anche il CFTR perde la sua funzione nella BPCO a causa dello stress ossidativo indotto dal fumo.
Finora i segnali sono contrastanti. Novartis però ha iniziato uno studio di fase 2b sul dosaggio e i risultati sono revisti per la prima metà del prossimo anno, mentre un trial di fase 3 è previsto per il 2023. In parallelo c’è anche uno studio di prova del concetto di icenticaftor nelle bronchiectasie, un’altra condizione polmonare cronica associata all’eccesso di muco.
7. Vaccini per il virus respiratorio sinciziale (RSV) di GSK, Pfizer e J&J
Obiettivo del 2022 sarà portare sul mercato il primo vaccino per il virus respiratorio sinciziale (RSV), che può causare gravi infezioni toraciche e morte nei bambini molto giovani e molto anziani. In corsa anche in questo caso tre aziende: GlaxoSmithKline, Pfizer e Johnson & Johnson.
GSK3844766A/GSK3888550A di GSK e RSVpreF di Pfizer sono vaccini a subunità proteiche ricombinanti, mentre l’adenovirale VAC18193 di J&J utilizza la stessa piattaforma tecnologica del vaccino contro il COVID-19. I vaccini GSK e Pfizer sono in fase di sviluppo per due applicazioni: come vaccino materno destinato a proteggere i bambini dall’RSV nei primi mesi di vita e come vaccino per gli adulti più anziani, mentre J&J si sta attualmente concentrando principalmente sul mercato degli adulti.
Tutti e tre i vaccini hanno generato risultati positivi quest’anno negli studi intermedi che esaminano principalmente la stimolazione degli anticorpi neutralizzanti l’RSV e sono in corso studi di fase 3 che dovrebbero portare ai primi risultati nel 2022. C’è molto in gioco per tutte e tre le aziende farmaceutiche. Gli analisti di Leerink hanno fissato il mercato potenziale per le vaccinazioni RSV materne a 3 miliardi di dollari nel 2030, che salgono a 7 miliardi di dollari nello stesso anno se si include il mercato degli adulti.
Altre case farmaceutiche hanno candidati al vaccino RSV che sono in fase di sviluppo precedente, incluso un vaccino a base di mRNA di Moderna che ha iniziato una sperimentazione di fase 2/3 a novembre negli adulti. Sanofi ha affermato di aspettarsi risultati della fase 1/2 con un vaccino RSV vivo e attenuato per i bambini piccoli l’anno prossimo, e la società ha anche un vaccino a mRNA mirata al mercato degli adulti che dovrebbe iniziare i test clinici nel 2023.
8. Elacestrant di Menarini e Radius per i ltumore al seno
Una delle principali sfide del 2022 sarà portare sul mercato una nuova classe di farmaci per il cancro al seno che promettono di fornire un’alternativa orale a un farmaco iniettabile ampiamente utilizzato.
Lo sviluppo di degradatori selettivi del recettore degli estrogeni orali (SERD) è stata una gara a tre tra AstraZeneca, Roche e Sanofi per un po’ di tempo, fino a quando una denuncia tardiva del Gruppo Menarini e del suo partner, Radius Health, ha spinto il loro candidato in testa.
Menarini e Radius hanno riportato i dati migliori da uno studio di fase 3 del loro farmaco, elacestrant, il che li ha spinti a preparare i documenti normativi negli Stati Uniti e in Europa il prossimo anno. I due hanno in programma di pubblicare l’intero set di dati a dicembre del 2021 e sono sulla buona strada per battere le offerte di approvazione per giredestrant di Roche, amcenestrant di Sanofi e camizestrant di AZ.
C’è molto dibattito sul mercato potenziale per i SERD orali, dato che dovranno affrontare i trattamenti attuali, molti dei quali sono disponibili come generici a basso costo. I SERD orali potrebbero offrire un’opzione più amichevole per il paziente e anche spostare la classe nell’impostazione di prima linea, dove competerebbero con gli inibitori dell’aromatasi orali come l’anastrozolo, che può essere difficile da tollerare, e i bloccanti del recettore degli estrogeni come il tamoxifene.
I loro sviluppatori ritengono che il SERDS orale offrirà meno effetti collaterali e un blocco più completo degli estrogeni rispetto a farmaci come il tamoxifene, poiché si legano ai recettori degli estrogeni e li eliminano, piuttosto che semplicemente bloccare la segnalazione.
9. Sotatercept di Msd
 L’acquisizione da 11,5 miliardi di dollari di Acceleron da parte di Msd è stata una delle più grandi operazioni di fusione e acquisizione di biotecnologie nel 2021 ed è notevole perché gran parte del valore era legato a una risorsa: il candidato all’ipertensione arteriosa polmonare (PAH) sotatercept. Il punto di svolta arriverà nel 2022, quando lo studio STELLAR emetterà il suo verdetto e il ruolo del farmaco nell’affollato mercato della PAH diventerà più chiaro.
L’acquisizione da 11,5 miliardi di dollari di Acceleron da parte di Msd è stata una delle più grandi operazioni di fusione e acquisizione di biotecnologie nel 2021 ed è notevole perché gran parte del valore era legato a una risorsa: il candidato all’ipertensione arteriosa polmonare (PAH) sotatercept. Il punto di svolta arriverà nel 2022, quando lo studio STELLAR emetterà il suo verdetto e il ruolo del farmaco nell’affollato mercato della PAH diventerà più chiaro.
Ci sono già molti farmaci disponibili per trattare la PAH, una malattia che porta ad alta pressione sanguigna nei polmoni, sebbene tutti siano progettati per trattare i sintomi della PAH. Al contrario, sotatercept mira a diventare la prima terapia che affronta la patologia sottostante della malattia.
Gli attuali farmaci agiscono tutti rilassando i vasi sanguigni e includono antagonisti del recettore dell’endotelina (Actelion’s Tracleer e Opsumit e Gilead’s Letairis), inibitori della PDE5 riproposti (Viatris’ Revatio e United’s Adcirca) e prostacicline (United’s Remodulin e Janssen’s Uptravi). Sotatercept invece è un modulatore del TGF-beta progettato per riequilibrare il BMP e le vie di segnalazione dell’attivina che si ritiene causino il rimodellamento dei vasi sanguigni nella PAH.
Se sotatercept raggiungerà gli obiettivi prefissati con lo studio STELLAR, gli osservatori del settore prevedono che potrebbe avere un picco di vendite di 2 miliardi di dollari o più e diventare la pietra angolare della terapia per la Pah. Finora, le prove degli studi clinici sono incoraggianti. STELLAR sta valutando la capacità di sotatercept di migliorare la capacità di esercizio di un paziente con PAH misurata dal test del cammino di sei minuti quando aggiunto alla terapia di base. I risultati sono attesi per la fine del 2022.
10. Zilebesiran di Alnylam e Novartis per l’ipertensione
Alnylam e il partner Novartis hanno aperto la strada dei farmaci farmaci basati sull’interferenza dell’RNA  (RNAi), o silenziamento genico, con inclisiran, un trattamento RNAi semestrale per l’abbassamento del colesterolo, approvato come Leqvio in Europa e recentemente ripubblicato negli Stati Uniti dopo un primo rigetto da parte della FDdaa causa di problemi di produzione. Ora, Alnylam spera di seguire una strategia simile per l’ipertensione con il suo farmaco RNAi zilebesiran (ex ALN-AGT), progettato per essere somministrato due o quattro volte l’anno.
(RNAi), o silenziamento genico, con inclisiran, un trattamento RNAi semestrale per l’abbassamento del colesterolo, approvato come Leqvio in Europa e recentemente ripubblicato negli Stati Uniti dopo un primo rigetto da parte della FDdaa causa di problemi di produzione. Ora, Alnylam spera di seguire una strategia simile per l’ipertensione con il suo farmaco RNAi zilebesiran (ex ALN-AGT), progettato per essere somministrato due o quattro volte l’anno.
Il farmaco è indicato per l’ipertensione resistente, che persiste nonostante il trattamento farmacologico, e riguarda circa il 20-25% di tutti i pazienti. Inoltre, il dosaggio giornaliero con terapie orali può causare variabilità nel controllo della pressione sanguigna e una protezione inferiore durante la notte, problemi che un farmaco iniettabile a lunga durata d’azione potrebbe benissimo affrontare.
L’RNAI prende di mira l’angiotensinogeno (AGT), parte di un sistema ormonale che regola la pressione sanguigna e l’equilibrio dei liquidi nel corpo. In uno studio di fase 1 è risultato essere ben tollerato per 12 settimane, con una riduzione durevole e dose-dipendente dei livelli di AGT nel sangue e miglioramenti della pressione sanguigna sistolica con una singola iniezione.
Alnylam ha avviato uno studio di fase 2 nell’ipertensione da lieve a moderata (KARDIA-1) che sta testando il farmaco come monoterapia in circa 375 pazienti per vedere se può aiutare a controllare la pressione sanguigna in modo sicuro. I risultati sono attesi verso la fine del 2022.
È inoltre previsto l’avvio di un secondo studio di fase 2 leggermente più ampio entro la fine dell’anno (KARDIA-2), che esaminerà il potenziale del farmaco come terapia aggiuntiva ai tradizionali farmaci per la pressione sanguigna in circa 800 pazienti con ipertensione non controllata.
Related news: Sviluppo di nuovi farmaci