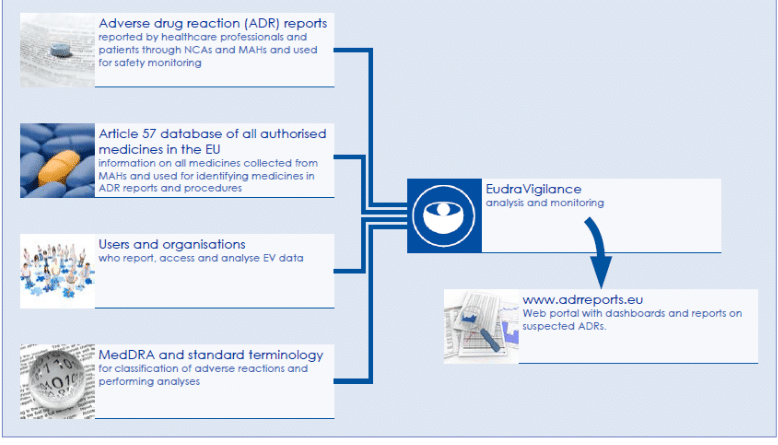
La nuova e migliorata EudraVigilance ” (EudraVigilance as Link), il sistema europeo per la gestione e l’analisi delle informazioni sulle sospette reazioni avverse ai medicinali autorizzati o studiati in studi clinici nell’UE, ha ricevuto più di 2 milioni di segnalazioni di sospetti effetti collaterali nel 2018. Si tratta di un aumento del 37% rispetto al 2017, che riflette in gran parte il fatto che a novembre 2017 le autorità nazionali competenti e i titolari dell’autorizzazione all’immissione in commercio dovevano segnalare casi non gravi di sospette reazioni avverse a EudraVigilance, avendo precedentemente riferito solo casi gravi.
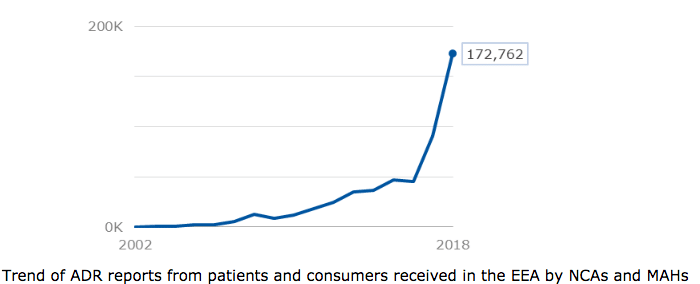 Questo è stato anche un fattore chiave per l’aumento del numero di segnalazioni ricevute da pazienti e consumatori europei attraverso autorità nazionali e titolari di autorizzazioni all’immissione in commercio, che sono quasi raddoppiate tra il 2017 e il 2018. I miglioramenti nella segnalazione dei pazienti riflettono anche gli sforzi a livello nazionale per incoraggiare i pazienti a condividere informazioni sugli effetti collaterali attraverso campagne di informazione. Questi e altri risultati sono riassunti nel rapporto iconografico di EMA in formato PDF su Eudravigilance pubblicato oggi.
Questo è stato anche un fattore chiave per l’aumento del numero di segnalazioni ricevute da pazienti e consumatori europei attraverso autorità nazionali e titolari di autorizzazioni all’immissione in commercio, che sono quasi raddoppiate tra il 2017 e il 2018. I miglioramenti nella segnalazione dei pazienti riflettono anche gli sforzi a livello nazionale per incoraggiare i pazienti a condividere informazioni sugli effetti collaterali attraverso campagne di informazione. Questi e altri risultati sono riassunti nel rapporto iconografico di EMA in formato PDF su Eudravigilance pubblicato oggi.
Secondo il rapporto, l’EMA ha esaminato oltre 2.200 sintomi potenziali. Si tratta di informazioni su una nuova reazione avversa o nuovo aspetto di una reazione avversa nota potenzialmente causata da un medicinale e che richiede ulteriori indagini. Quasi l’80% di questi sintomi proveniva 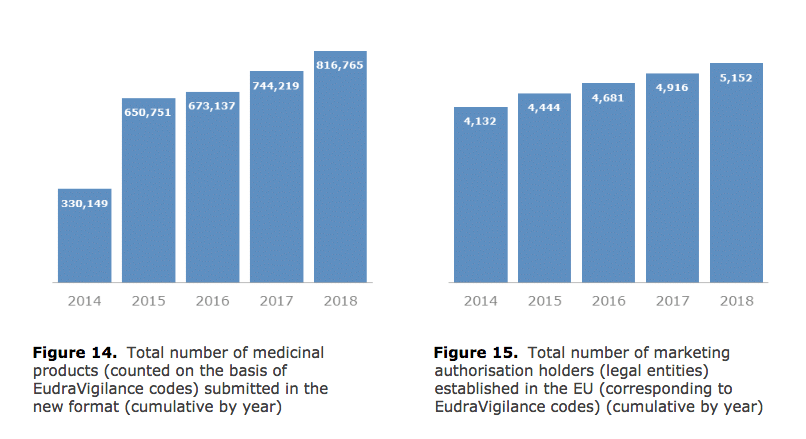 dal monitoraggio del database EudraVigilance. Altri segnali sono stati generati da studi clinici e letteratura scientifica.
dal monitoraggio del database EudraVigilance. Altri segnali sono stati generati da studi clinici e letteratura scientifica.
Il comitato per la sicurezza (PRAC) dell’Agenzia ha valutato 114 segnali di sicurezza nel 2018, il 40% in più rispetto al 2017. Il 44% dei segnali valutati dal PRAC ha portato direttamente a una raccomandazione per modificare le informazioni sul prodotto per pazienti e operatori sanitari, garantendo così la sicurezza e uso efficace dei farmaci.
Sia l’EMA che le autorità nazionali competenti sono tenute dalla legislazione a monitorare costantemente i dati di reazione avversa segnalati a EudraVigilance per determinare se vi sono rischi nuovi o modificati e se hanno un impatto sul rapporto rischio/beneficio complessivo di un medicinale. Con oltre 14,5 milioni di report sulla sicurezza dei casi individuali in totale, Eudravigilance è uno dei più grandi database di farmacovigilanza al mondo e un potente strumento per gli enti regolatori nell’UE per monitorare la sicurezza dei farmaci.
EudraVigilance fornisce anche dati direttamente al Centro di monitoraggio Uppsala dell’Organizzazione Mondiale della Sanità (OMS). Con oltre 1 milione di segnalazioni di casi individuali inoltrate all’OMS nel 2018, EudraVigilance fornisce un contributo significativo alla protezione della salute pubblica in tutto il mondo.
Una versione migliorata del sistema EudraVigilance nel novembre 2017 ha semplificato la segnalazione di sospette reazioni avverse, ha consentito una migliore analisi dei dati a beneficio della sicurezza dei pazienti in Europa e ha aumentato la trasparenza e l’accessibilità di questi casi clinici
marketing authorisation holders





