
Requisiti per l’informazione sui medicinali
 L’Agenzia europea per i medicinali (EMA) fornisce linee guida e modelli per fornire ai richiedenti l’autorizzazione all’immissione in commercio consigli pratici su come redigere le informazioni sui medicinali per uso umano, che includono il riassunto delle caratteristiche del prodotto, l’etichettatura e il foglio illustrativo.
L’Agenzia europea per i medicinali (EMA) fornisce linee guida e modelli per fornire ai richiedenti l’autorizzazione all’immissione in commercio consigli pratici su come redigere le informazioni sui medicinali per uso umano, che includono il riassunto delle caratteristiche del prodotto, l’etichettatura e il foglio illustrativo.
La guida dell’EMA spiega il contenuto che dovrebbe essere incluso in questi documenti, così come i titoli standard e le dichiarazioni standard e i termini più comunemente usati in tutte le lingue ufficiali dell’Unione Europea (UE) più islandese e norvegese, e definisce il formato e il layout del prodotto informazione.
Le linee guida dell’EMA non pregiudicano:
- eventuali posizioni finali dell’Agenzia, del Comitato per i medicinali per uso umano (CHMP) o delle istituzioni europee in merito al contenuto dei documenti;
- il carattere vincolante della normativa di riferimento;
- eventuali interpretazioni giuridiche fornite dalla Commissione Europea o dalla Corte di Giustizia dell’Unione Europea.
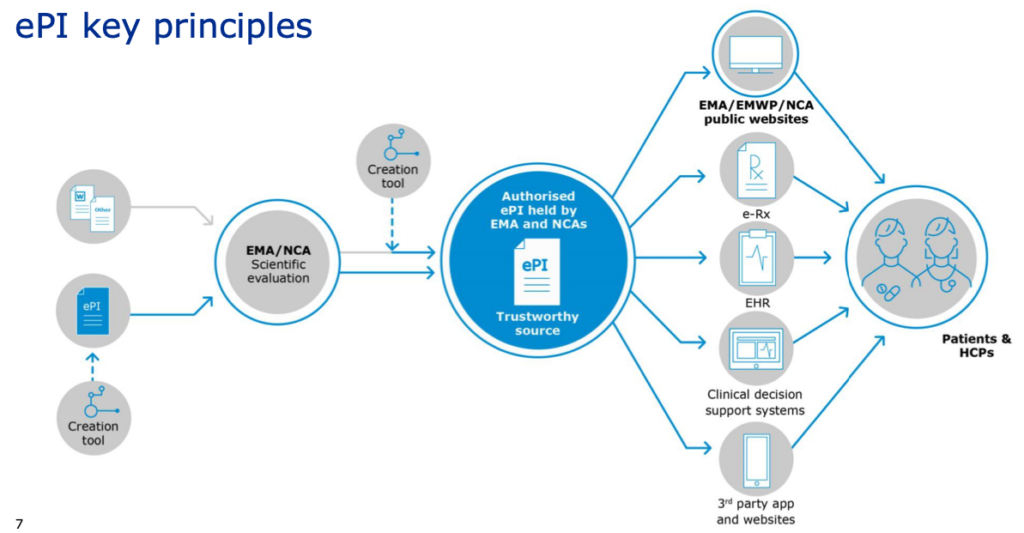
 Le informazioni elettroniche sul prodotto (ePI) si riferiscono alle informazioni sul prodotto autorizzate e regolamentari per i medicinali (compreso il riassunto delle caratteristiche del prodotto RCP, il foglietto illustrativo e l’etichettatura) adattate per l’utilizzazione in formato elettronico e la diffusione tramite web, piattaforme elettroniche e su carta.
Le informazioni elettroniche sul prodotto (ePI) si riferiscono alle informazioni sul prodotto autorizzate e regolamentari per i medicinali (compreso il riassunto delle caratteristiche del prodotto RCP, il foglietto illustrativo e l’etichettatura) adattate per l’utilizzazione in formato elettronico e la diffusione tramite web, piattaforme elettroniche e su carta.
ePI utilizza un formato semistrutturato, basato su uno standard elettronico comune per le informazioni sui prodotti.
Aggiornamento: è disponibile lo standard comune ePI dell’UE, basato su Fast Healthcare Interoperability Resources (FHIR), uno standard tecnico che descrive i formati e gli elementi dei dati e un’interfaccia di programmazione dell’applicazione per lo scambio di cartelle cliniche elettroniche:
Stakeholders gave input to help identify the common standard during EMA’s public consultation and workshops in 2021:
-
Report on public consultation on EU Common Standard for electronic product information (ePI) – Summary of comments received and next steps(PDF/753.47 KB) (new) First published: 22/02/2022
-
EU Common Standard for electronic product information (ePI) – categorised comments received following public consultation (XLSX/186.42 KB) (new) First published: 22/02/2022
Notizie correlate: La tecnologia ePI





