L’Avv. Andrea Castelnuovo affronta alcune questioni giuridiche sulla responsabilità nella prescrizione del farmaco generico e spiega il fenomeno del biocreep
Milano, 04/11/2014 (informazione.it – comunicati stampa – salute e benessere) Un tema di matrice medico-legale che viene in esame parlando di farmaci generici è il fenomeno del cosiddetto bio creep.
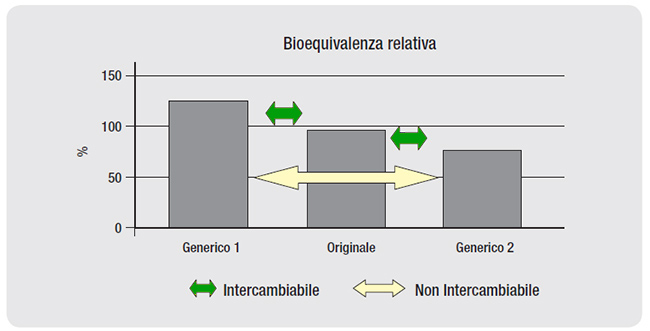
Sappiamo che può esistere e che è universalmente tollerata ed è ineluttabile una differenza del – 80% / +125% nella biodisponibilità di un farmaco rispetto all’altro. Sappiamo anche che, se il medico non apponga la clausola di non sostituibilità sulla prescrizione, il farmacista consegnerà al cliente il farmaco generico di minor prezzo.
Sappiamo, infine, che il principio della continuità terapeutica è un principio fondamentale, che costituisce una linea guida generale ed universale per qualunque approccio terapeutico rispetto a qualunque patologia: continui sbalzi, continue modificazioni comportano scompensi e alterazioni dello “stato stazionario” nel quale l’organismo faticosamente riesce a trovarsi dopo un periodo sufficientemente lungo di somministrazione di una determinata molecola.
 Pensiamo ora alla possibilità che il paziente incorra in un continuo switch multiplo tra originatore, generico A, generico B, generico C è così via: oggi egli si trova a Torino e il farmacista di da il generico A, tra un mese compra la scatola a Milano e farmacista gli dà il B, poi va in vacanza al mare e il farmacista gli dà il farmaco C. Tendenzialmente non succede nulla se l’intervallo di confidenza sia di molto inferiore a quel più o meno 20% che è il limite massimo di tolleranza: cioè, a parte i farmaci ad indice terapeutico ristretto (immunosoppressori, per esempio) e a parte pazienti per i quali qualsiasi farmaco potrebbe essere tale (bambini, donne in gravidanza, per esempio), se la differenza nella biodisponibilità tra i vari farmaci è minima non esiste un effetto negativo sensibile.
Pensiamo ora alla possibilità che il paziente incorra in un continuo switch multiplo tra originatore, generico A, generico B, generico C è così via: oggi egli si trova a Torino e il farmacista di da il generico A, tra un mese compra la scatola a Milano e farmacista gli dà il B, poi va in vacanza al mare e il farmacista gli dà il farmaco C. Tendenzialmente non succede nulla se l’intervallo di confidenza sia di molto inferiore a quel più o meno 20% che è il limite massimo di tolleranza: cioè, a parte i farmaci ad indice terapeutico ristretto (immunosoppressori, per esempio) e a parte pazienti per i quali qualsiasi farmaco potrebbe essere tale (bambini, donne in gravidanza, per esempio), se la differenza nella biodisponibilità tra i vari farmaci è minima non esiste un effetto negativo sensibile.
Il problema è che non esiste nessuna evidenza, e quindi nessuna possibilità per il medico prescrittore, per il farmacista e per il paziente di sapere se tra quel generico e il suo originatore vi sia una differenza del 2% in più o in meno, del 10% in più o in meno o del 20% .
Questi dati vengono custoditi gelosamente nei dossier di approvazione relativi all’immissione in commercio, non sono pubblicati in letteratura, in buona sostanza non si sa assolutamente nulla.
Esistono numerosi studi che hanno dimostrato come farmaci perfettamente regolari sotto profilo dell’autorizzazione all’immissione in commercio, sottoposti a test di biodisponibilità, abbiano in realtà dimostrato di sconfinare dal range + /- 20%, e addirittura vi sono studi che hanno dimostrato come certi farmaci (da lotto a lotto) non siano neppure bioequivalenti rispetto a se stessi.
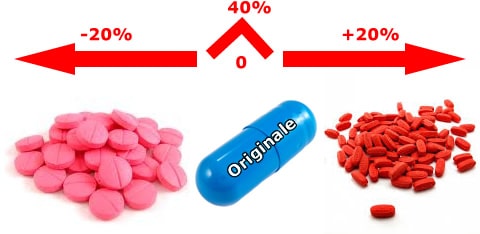
Posto che è insito nel concetto di bio-equivalenza lo scarto differenziale del +/- 20% di bio-disponibilità tra l’originatore ed ogni suo generico, se è vero che per definizione è scientificamente accettabile una differenza siffatta (pari alla variabilità interindividuale), è anche vero che a questo principio non è associata una piena proprietà commutativa: se tra l’originatore e il generico A c’è una differenza del + 20% e tra l’originatore e il generico B c’è una differenza del – 20%, la differenza tra il generico A ed il generico B sarà del 40% (che è il doppio del valore ritenuto tollerabile dalla legge) , ingenerandosi così un fenomeno di bio-creep potenzialmente pernicioso per il paziente.
E’ pur vero che differenze così ampie nella bio-disponibilità difficilmente si sono riscontrate negli studi effettuati per controllare il fenomeno, in quanto il più delle volte gli scarti sono risultati inferiori a quel famigerato 20%, tuttavia – come dicevo – la questione può assumere particolare rilievo per i farmaci a ristretto indice terapeutico.
E’ poi possibile che una continua alterazione possa riverberarsi, soprattutto nei pazienti farmacologicamente poli-trattati, sullo steady-state nel quale per definizione l’organismo si viene a trovare dopo un certo periodo dall’assunzione del farmaco.
Farmaco brand e farmaco generico: l’utilizzo nei pazienti con problemi cardiovascolari
– Il convengo AUDITA fa chiarezza sui temi più discussi relativi all’utilizzo dei farmaci nei pazienti più comuni, quelli con patologie cardiovascolari.
Prescrizioni mediche e sostituibilità dei farmaci nei pazienti con patologie cardiovascolari
– Durante il convengo AUDITA a Ivrea lo scorso 21 Giugno, il Prof. Vittorio Costa fa chiarezza sull’argomento con un focus su Ipertensione e Scompenso Cardiaco.
Farmaci generici: l’importanza dell’aderenza alla terapia
– Il prof. Claudio Borghi, Ordinario di Medicina Interna al Sant’Orsola Malpighi di Bologna, sottolinea l’importanza dell’aderenza alla terapia e quanto questa sia condizionata dalle caratteristiche del farmaco. L’aderenza può modificarsi se il paziente non riconosce nel farmaco generico quello con…
Differenza tra farmaci generici e brand, sostenibilità e obiettivi terapeutici
– Durante il convengo AUDITA a Ivrea lo scorso 21 Giugno, il Prof. Vittorio Costa spiega i benefici di una terapia costante nell’ambito delle patologie cardiovascolari.