L’Agenzia Italiana del Farmaco ha organizzato, in collaborazione con la Scuola Superiore della Magistratura, il corso di aggiornamento “Crimine farmaceutico: normative e strumenti di contrasto”,  focalizzato sull’analisi degli aspetti normativi e regolatori del settore farmaceutico e sulla valutazione delle casistiche riguardanti gli illeciti nel settore della produzione e della distribuzione dei medicinali, inclusi i casi di violazione delle disposizioni sulla vendita online e di furto e riciclaggio di farmaci.
focalizzato sull’analisi degli aspetti normativi e regolatori del settore farmaceutico e sulla valutazione delle casistiche riguardanti gli illeciti nel settore della produzione e della distribuzione dei medicinali, inclusi i casi di violazione delle disposizioni sulla vendita online e di furto e riciclaggio di farmaci.
Al corso, che si è tenuto a Roma il 19 maggio scorso, hanno partecipato circa 90 magistrati.
Gli interventi dei relatori sono stati incentrati sia sugli aspetti regolatori più rilevanti relativi ai medicinali per uso umano, che disciplinano la produzione, l’autorizzazione all’immissione in commercio, la distribuzione e l’importazione da Paesi esteri, sia sulle normative che disciplinano categorie specifiche come i medicinali stupefacenti e psicotropi.
È stato inoltre approfondito l’attuale sistema di tracciabilità del farmaco, che consente, attraverso l’apposizione del bollino a lettura ottica, il monitoraggio delle movimentazioni di ogni singola confezione di medicinale in ogni passaggio all’interno della filiera e che costituisce un utile strumento per le investigazioni.
Le normative specifiche del settore farmaceutico sono inoltre state poste a confronto con quelle che regolamentano altre tipologie di prodotti – quali i dispositivi medici, i cosmetici, gli alimenti e gli integratori alimentari – allo scopo di evidenziarne le peculiarità specifiche e le principali differenze. Attraverso la presentazione di casi reali, sono state condivise e analizzate le più frequenti tipologie di illeciti riconducibili al crimine farmaceutico.
L’evento ha rappresentato inoltre un’importante occasione di confronto sullo stato del processo di ratifica da parte italiana della Convenzione del Consiglio d’Europa sulla falsificazione dei prodotti farmaceutici (Convenzione MEDICRIME), della quale è stata auspicata la sollecita ratifica e implementazione – in particolare attraverso l’estensione anche alle persone giuridiche del regime di responsabilità per i reati oggetto della Convenzione – a distanza di oltre 10 anni dalla sua sottoscrizione.
AIFA Pubblicato il: 20 maggio 2022
____________________________________
Nota
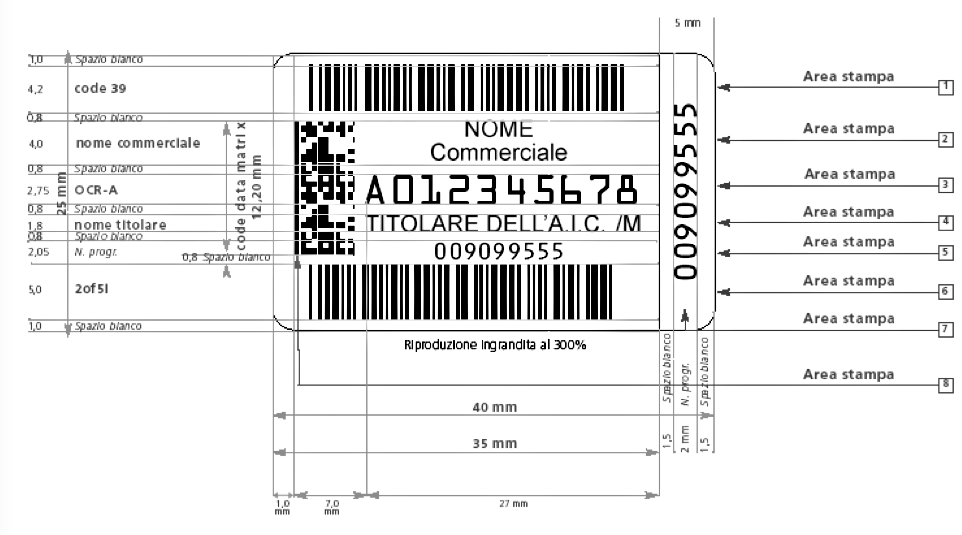
Per molto tempo la tracciabilità del farmaco è stata una caratteristica tutta italiana: essa si basa 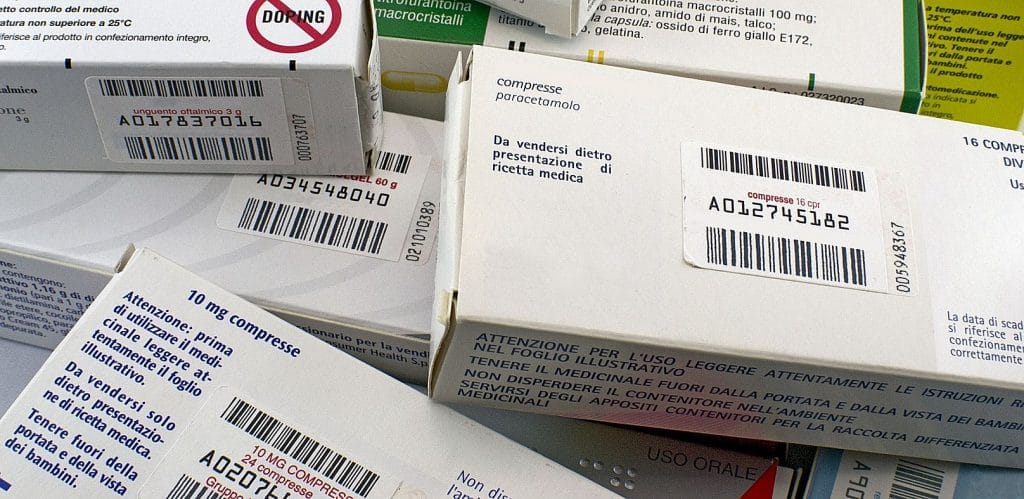 sull’apposizione di un bollino ottico riportante, in due codici a barre (uno superiore, l’altro inferiore) e in un datamatrix, tutte le informazioni sul medicinale. Un bollino, si noti, che oltre alla denominazione del titolare e del farmaco, al numero di autorizzazione all’immissione in commercio (AIC) e alla descrizione della confezione, include anche il numero progressivo del bollino stesso, attribuendo di fatto un codice univoco a ciascuna confezione.
sull’apposizione di un bollino ottico riportante, in due codici a barre (uno superiore, l’altro inferiore) e in un datamatrix, tutte le informazioni sul medicinale. Un bollino, si noti, che oltre alla denominazione del titolare e del farmaco, al numero di autorizzazione all’immissione in commercio (AIC) e alla descrizione della confezione, include anche il numero progressivo del bollino stesso, attribuendo di fatto un codice univoco a ciascuna confezione.
Per la sicurezza delle specialità medicinali, è stato implementato un sistema di trasmissione dei dati di tracciabilità a livello europeo, entrato in vigore nel febbraio 2019. Tuttavia, essendo già dotata di un sistema proprio, l’Italia ha ottenuto una proroga per l’adeguamento al sistema europeo.
Pertanto, fino al 2025 (data in cui anche in Italia entrerà in vigore il nuovo sistema di serializzazione europeo) la tracciabilità del farmaco continuerà a prevedere la presenza di una Banca Data centralizzata presso il Ministero della Salute, nella quale vengono registrati i movimenti delle singole confezioni tramite i dati di produzione e fornitura dei bollini ottici. L’art. 40 della Legge 1° marzo 2002 n. 39, che istituisce la Banca Dati, sono tutti gli attori della filiera farmaceutica a dover archiviare e trasmettere ad essa le informazioni di tracciabilità, con tempistiche precise e ben definite.
La tracciabilità è dunque un obbligo di tutti coloro che partecipano alla produzione e distribuzione del farmaco, a partire dal produttore passando per i depositari e i grossisti fino alle farmacie, gli ospedali e le parafarmacie. Essa riguarda anche lo smaltimento di farmaci scaduti o inutilizzabili.
I produttori, i distributori e i grossisti hanno quindi l’obbligo di registrarsi alla Banca Dati e di trasmettere ad essa i dati delle movimentazioni delle confezioni di medicinali a uso umano e veterinario. Alla Banca Dati i produttori, i distributori e i grossisti dovranno inoltre trasmettere anche i valori economici delle movimentazioni.
Notizie correlate: Caratteristiche tecniche del bollino farmaceutico