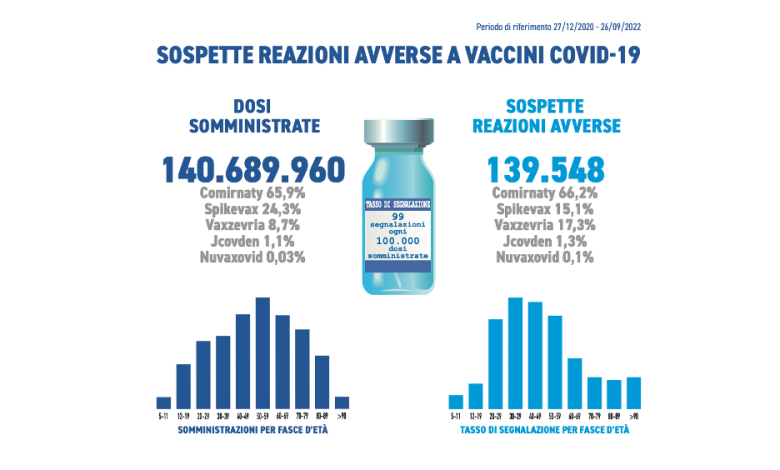
L’Agenzia Italiana del Farmaco ha pubblicato il tredicesimo Rapporto di farmacovigilanza sui vaccini anti- COVID-19. I dati raccolti e analizzati riguardano le segnalazioni di sospetta reazione avversa registrate nella Rete Nazionale di Farmacovigilanza tra il 27 dicembre 2020 e il 26 settembre 2022 per i vaccini in uso nella campagna vaccinale in corso.
COVID-19. I dati raccolti e analizzati riguardano le segnalazioni di sospetta reazione avversa registrate nella Rete Nazionale di Farmacovigilanza tra il 27 dicembre 2020 e il 26 settembre 2022 per i vaccini in uso nella campagna vaccinale in corso.
They were received during the period in question 139.548 segnalazioni out of a total of 140.689.690 di dosi administered (reporting rate of 99 ogni 100.000 dosi), of which the81,5% riferite a eventi non gravisuch as injection site pain, fever, asthenia/fatigue, muscle aches.
Nel terzo trimestre del 2022 i tassi di segnalazione relativi alla 1a dose restano più elevati rispetto alle dosi successive e sono notevolmente più bassi dopo la 4a dose (2a dose booster) per i vaccini per i quali è prevista.
Le segnalazioni gravi corrispondono al 18,5% del totale, con un tasso di 18 eventi gravi ogni 100.000 dosi somministrate, in linea con i precedenti Rapporti. Si ricorda che la gravità delle segnalazioni viene definita in base a criteri standardizzati che non sempre coincidono con la reale gravità clinica dell’evento.
Gli eventi avversi più segnalati per tutti i vaccini, indipendentemente dalla gravità, sono febbre, cefalea, dolori muscolari/articolari, brividi, disturbi gastro-intestinali, reazioni vegetative, stanchezza, reazione locale o dolore  in sede di iniezione.
in sede di iniezione.
Al 26/09/2022, le vaccinazioni con le formulazioni bivalenti aggiornate alle nuove varianti Omicron erano già iniziate ma non si registravano segnalazioni di sospette reazioni avverse.
The data contained in this Periodic Report are consistent with those published to date and in line with the safety information already discussed at European level.
AIFA – Pubblicato il: 03 novembre 2022
Tredicesimo Rapporto di farmacovigilanza sui vaccini anti-COVID-19
Related news: EMA recommends approval of Comirnaty and Spikevax COVID-19 vaccines for children from 6 months of age
EMA recommends approval of second adapted Spikevax vaccine
EMA. COVID-19 vaccines: authorised
EMA. Safety of COVID-19 vaccines






