
I governi dell’ultimo ventennio, d’accordo con le più grandi multinazionali del farmaco, hanno ben capito che incentivare la progressione di una malattia, piuttosto che ricercarne la cura, è un’enorme fonte di guadagno. E’ il caso dell’Epatite C, malattia del fegato causata dal virus Hcv che causa, dapprima, un malfunzionamento epatico, poi la cicatrizzazione del tessuto epatico (cirrosi), e più tardi lo sviluppo del carcinoma epatico.
governi dell’ultimo ventennio, d’accordo con le più grandi multinazionali del farmaco, hanno ben capito che incentivare la progressione di una malattia, piuttosto che ricercarne la cura, è un’enorme fonte di guadagno. E’ il caso dell’Epatite C, malattia del fegato causata dal virus Hcv che causa, dapprima, un malfunzionamento epatico, poi la cicatrizzazione del tessuto epatico (cirrosi), e più tardi lo sviluppo del carcinoma epatico.
La malattia, spesso silente per anni dopo il contagio, è così diffusa per via delle infezioni contratte, nei decenni passati, con l’utilizzo di sangue infetto e materiale non sterilizzato correttamente. Il nostro paese conta circa 800 mila persone affette da Hcv.
Il trattamento dell’epatite C ha subito un notevole progresso. Sino a poco tempo fa la percentuale di successo dei farmaci si attestava soltanto intorno al 50%, per via dei pesantissimi effetti collaterali degli stessi. Negli ultimi anni fortunatamente sono state utilizzate diverse combinazioni di farmaci, capaci di agire su differenti meccanismi.
Da quasi tre anni viene commercializzata una nuova molecola, un nuovo farmaco antivirale che impedisce direttamente la replicazione del virus Hcv, inibendo l’enzima Rna polimerasi Rna-dipendente (NS5B), il nome del cui principio attivo è Sofosbuvir; il nome commerciale è, invece, Sovaldi.
 La differenza sostanziale tra Sofosbuvir ed altri farmaci usati per eliminare il virus dell’epatite C (come Peg-IFN e ribavirina) sta nel fatto che questo nuovo farmaco agisce direttamente contro il virus, bloccandone il processo di replicazione. L’interferone, invece, stimola la risposta del sistema immunitario contro il virus e la ribavirina interferisce indirettamente sulla replicazione virale. L’assunzione combinata di questi farmaci incrementa la possibilità di eradicazione definitiva del virus. Sofosbuvir può essere assunto soltanto insieme a ribavirina e/o interferone pegilato, sin dal primo giorno di trattamento.
La differenza sostanziale tra Sofosbuvir ed altri farmaci usati per eliminare il virus dell’epatite C (come Peg-IFN e ribavirina) sta nel fatto che questo nuovo farmaco agisce direttamente contro il virus, bloccandone il processo di replicazione. L’interferone, invece, stimola la risposta del sistema immunitario contro il virus e la ribavirina interferisce indirettamente sulla replicazione virale. L’assunzione combinata di questi farmaci incrementa la possibilità di eradicazione definitiva del virus. Sofosbuvir può essere assunto soltanto insieme a ribavirina e/o interferone pegilato, sin dal primo giorno di trattamento.
Il Sofosbuvir (Sovaldi) è stato scoperto da Pharmasset e poi acquisito per la commercializzazione da Gilead Sciences. In Italia, Sovaldi è commercializzato dal marzo 2013 ed è prescrivibile da parte dei centri autorizzati dall’Agenzia Italiana del Farmaco (dunque a carico del Ssn), solo per pazienti affetti da epatite cronica C in fase avanzata di malattia, per pazienti in stato di cirrosi epatica o per i pazienti candidati al trapianto di fegato.
I pazienti affetti da malattia allo stadio iniziale possono curarsi con Sofosbuvir solo a proprie spese (35 mila euro);dunque solo i ricchi potranno curarsi. La Procura di Torino ha infatti, nei mesi passati, aperto un fascicolo contro ignoti per omissione di cure e lesioni colpose, in relazione alle problematiche di sofosbuvir e ai suoi costi per il sistema sanitario pubblico.
pazienti affetti da malattia allo stadio iniziale possono curarsi con Sofosbuvir solo a proprie spese (35 mila euro);dunque solo i ricchi potranno curarsi. La Procura di Torino ha infatti, nei mesi passati, aperto un fascicolo contro ignoti per omissione di cure e lesioni colpose, in relazione alle problematiche di sofosbuvir e ai suoi costi per il sistema sanitario pubblico.
Il dato più contestato vede l’enorme differenza di prezzo del farmaco tra il nostro paese (35 mila euro) e l’India, paese in cui l’intero ciclo terapeutico non supera i mille euro.
Alla base dei costi elevati vi sarebbero la sperimentazione e i brevetti. Come affermava già lo scorso anno Luca Pani, presidente dell’Aifa, «Il valore di un farmaco non è mai quello della sua produzione in quanto tale ma devono essere comprensibili i meccanismi che portano alla definizione del prezzo finale tenendo conto per esempio degli investimenti in sviluppo clinico, sperimentazioni e anche della ragionevole protezione brevettuale. Quello che pare poco chiaro è come l’azienda produttrice abbia determinato il prezzo del Sofosbuvir, che risulta, secondo le stime Aifa, comunque più elevato del previsto anche considerando i costi di sviluppo e di produzione».
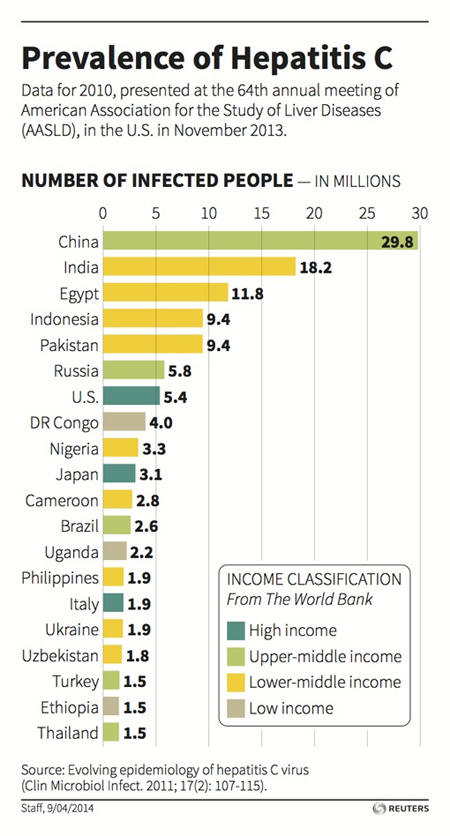 Motivo per cui continuano i “Viaggi della Speranza” verso l’India. Perché? L’ufficio brevetti di Delhi lo scorso gennaio ha respinto la richiesta di registrazione avanzata dall’azienda produttrice ritenendo non abbastanza innovativa la sua molecola, cioè il sofosbuvir (principio attivo del Sovaldi).
Motivo per cui continuano i “Viaggi della Speranza” verso l’India. Perché? L’ufficio brevetti di Delhi lo scorso gennaio ha respinto la richiesta di registrazione avanzata dall’azienda produttrice ritenendo non abbastanza innovativa la sua molecola, cioè il sofosbuvir (principio attivo del Sovaldi).
Combattere il cosiddetto meccanismo dell’evergreening (cioè “il cosiddetto “Brevetto Sempre Verde”, ovvero una strategia di mercato propria delle case farmaceutiche per conservare il più possibile il brevetto su un prodotto apportando piccole modifiche, come l’aggiunta di un eccipiente) è una questione vitale per il Paese. Si tratta di difendere il diritto alla sanità per i suoi 1,2 miliardi di abitanti, la cui metà vive sotto la soglia di povertà. Messa con le spalle al muro, la Gilead ha autorizzato alcune industrie di farmaci generici a produrre la pillola e di venderla al prezzo di un dollaro in 91 Paesi in via di sviluppo, compresa l’India.
L’Italia, nel rispetto delle leggi internazionali sulla tutela del brevetto, non può comprare il Sovaldi dalle ditte genericiste indiane. L’India è riuscita, ancora una volta, a confermarsi ‘la farmacia low-cost del globo’, essendo il principale fornitore al mondo di farmaci generici per la cura del cancro, tubercolosi e Aids. La sua battaglia contro la casta delle industrie farmaceutiche infatti dura da anni.
In Italia, il 70 per cento dei pazienti non può curarsi a proprie spese dato l’eccessivo costo della terapia; perché dunque limitare l’utilizzo di Sofosbuvir solo alle fasi avanzate della malattia? Curare precocemente significherebbe eradicare il virus prima che arrivi a danneggiare irreversibilmente il fegato.
In Italia, dunque, si vuole rendere contagiosa la salute o, piuttosto, la malattia?
di Enrico Alagna | 14 gennaio 2016 | Il Fatto Quotidiano.it
Notizie correlate: Epatite cronica, al Policlinico Federico II un contact center per facilitare la comunicazione tra medici e pazienti






