Il 26 settembre, a Roma, il seminario di AboutPharma sui nuovi obblighi di farmacovigilanza online. Gli obblighi di legge dell’ISF
di Redazione
I pazienti ricorrono sempre più frequentemente a “Doctor Web”; non solo per ricevere diagnosi – spesso improbabili – o suggerimenti su rimedi e terapie, ma anche per segnalare effetti indesiderati o eventi avversi conseguenti all’uso dei farmaci. Non di rado disperdono queste segnalazioni fra Forum e Social Network: spazi digitali sconfinati, sui quali sembra arduo riuscire a esercitare una sorveglianza efficace e tempestiva. Arduo, ma forse non impossibile, servendosi delle più moderne tecnologie per il monitoraggio della Rete. Le normative, allora, potrebbero aggiornarsi in conseguenza dell’evoluzione tecnologica, giacché, come insegnavano i padri del diritto, nessuno può essere obbligato a ottenere risultati impossibili; ma quando si spostano i confini del tecnicamente possibile – e oggi la Rete si può effettivamente monitorare con efficacia sorprendente – è forse arrivato il momento di modificare di conseguenza i contorni degli obblighi giuridici; tanto più quando l’interesse da tutelare è la sicurezza dei pazienti.
Sembrano essersi mossi in questa direzione, e in base a questa logica, anche le Autorità europee: il Regolamento UE 1235/2010, la Direttiva 2010/ 84/UE e tutti gli atti collegati introducono modifiche molto importanti all’impianto normativo sulla farmacovigilanza, con l’obiettivo di aumentare l’efficacia, la rapidità e la trasparenza degli interventi. In questo contesto si inserisce anche il paragrafo VI B.1.1.4. delle linee guida sulle GVP (Good Pharmacovilance Practices) emanate dall’Ema (European Medicines Agency). Il paragrafo s’intitola esplicitamente “Information on suspected adverse reactions from the Internet or digital media” e stabilisce l’obbligo, per i titolari di AIC, di monitorare regolarmente i siti internet e i media digitali che siano online sotto la propria gestione o responsabilità: ciò, naturalmente, per intercettare prontamente, e girare alle autorità preposte, eventuali segnalazioni di sospette reazioni avverse “disseminate” in rete dai pazienti. Sul punto è intervenuta anche l’AIFA, con un comunicato del 7 febbraio 2014, richiamando la previsione dell’Ema e affermando l’obbligo, per le imprese farmaceutiche, di considerare eventuali informazioni acquisite sulla Rete come segnalazioni spontanee di reazioni avverse, con l’ulteriore obbligo, conseguente, di notificare alle autorità regolatorie quelle considerate valide e attendibili.
Il seminario di AboutPharma, in programma per il prossimo 26 settembre a Roma, mira a definire i contorni precisi dei nuovi obblighi di farmacovigilanza sul web, e per farlo riunirà un panel di relatori in grado di affrontare tutti gli spetti della questione: giuristi specializzati, informatici esperti di tecniche di monitoraggio online, responsabili e coordinatori regionali di farmacovigilanza e infine i responsabili di farmacovigilanza presso alcune delle maggiori multinazionali farmaceutiche presenti in Italia.
Il seminario si rivolge al personale coinvolto nei processi di farmacovigilanza e nell’attività di monitoraggio della rete delle imprese farmaceutiche: Responsabili farmacovigilanza, Officers, QPPV, Responsabili qualità, Responsabili affari legali e regolatori, ICT manager, Referenti web marketing e comunicazione. Questi professionisti possono già iscriversi attraverso l’apposito modulo online.
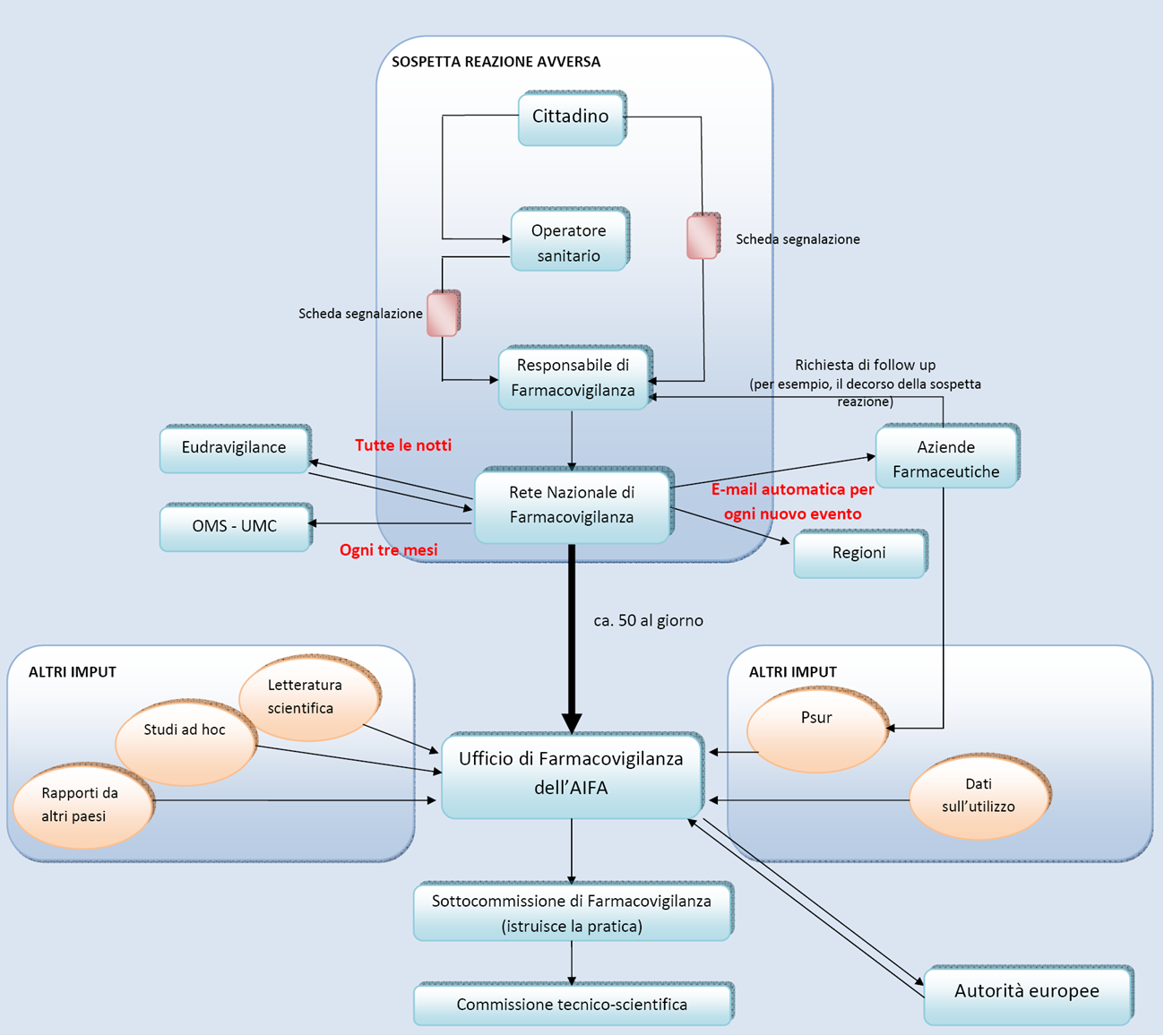
Memorandum. Ricordiamo che gli Informatori Scientifici del Farmaco in base all’art. 122 comma 6 del D. Lgs. 219/06
– “devono riferire al servizio scientifico di cui all’articolo 126, dal quale essi dipendono, ed al responsabile del servizio di farmacovigilanza di cui al comma 4 dell’articolo 130, tutte le informazioni sugli effetti indesiderati dei medicinali, allegando, ove possibile, copia delle schede di segnalazione utilizzate dal medico ai sensi del titolo IX”.
E all’art 131 si specifica; che il Responsabile di Farmacovigilanza assicura
– a) l’istituzione ed il funzionamento di un sistema atto a garantire che le informazioni su tutte le presunte reazioni avverse comunicate al personale dell’azienda ed agli informatori medico-scientifici, sono raccolte, ordinate e accessibili in un unico luogo;
– b) che tutte le informazioni relative alla sicurezza dei medicinali, successive all’atto dell’autorizzazione, siano portate rapidamente a conoscenza del personale sanitario anche tramite i contatti del servizio di informazione scientifica della propria azienda.