Rapporto sulle tempistiche delle procedure di prezzo e rimborso dei farmaci nel quadriennio 2018-2021
AIFA – 13 aprile 2022
 L’Agenzia Italiana del Farmaco ha condotto un aggiornamento dell’analisi sulle tempistiche di autorizzazione delle procedure di prezzi e rimborso dei farmaci relativamente al quadriennio 2018-2021, con l’obiettivo finale di monitorare e migliorare la qualità del servizio reso.
L’Agenzia Italiana del Farmaco ha condotto un aggiornamento dell’analisi sulle tempistiche di autorizzazione delle procedure di prezzi e rimborso dei farmaci relativamente al quadriennio 2018-2021, con l’obiettivo finale di monitorare e migliorare la qualità del servizio reso.
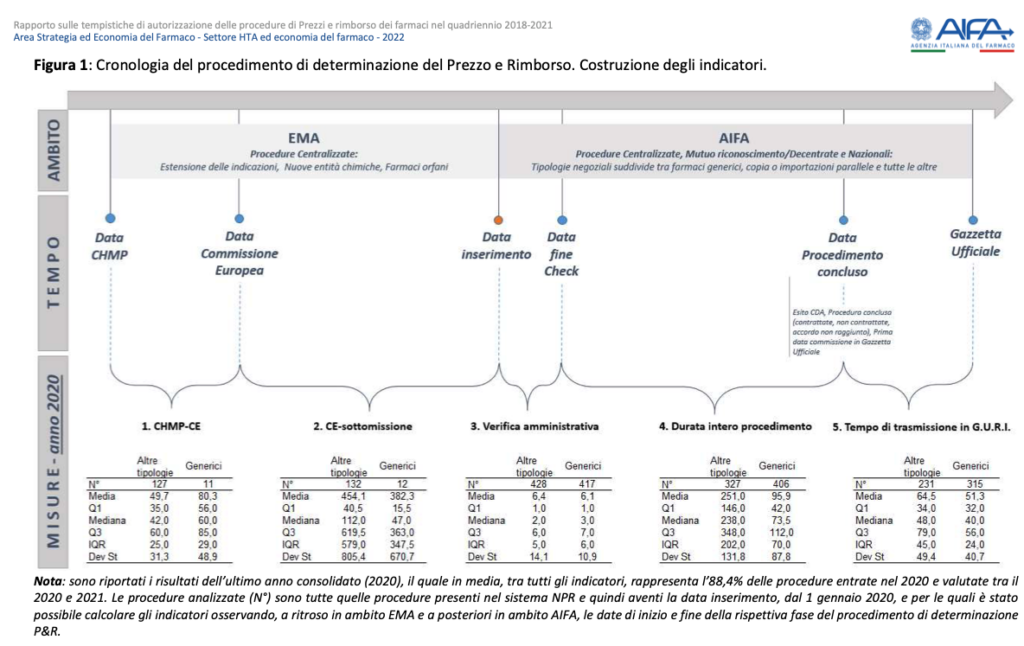
Lo studio misura le tempistiche attraverso cinque indicatori, di cui i primi due rappresentano una novità rispetto alla precedente pubblicazione: il tempo che intercorre tra la data del parere positivo espresso dal Committee for Medicinal Products for Human Use (CHMP) relativa ad un farmaco autorizzato con procedura Centralizzata, e la data di decisione da parte della Commissione Europea (CE); il tempo che intercorre tra la data della decisione della Commissione Europea e la data di presentazione in AIFA dell‘istanza di P&R; il tempo di verifica amministrativa misura il numero di giorni che intercorrono dalla presentazione della domanda da parte delle aziende farmaceutiche al completamento della verifica amministrativa; la durata complessiva del procedimento misura i tempi necessari per la sua conclusione, comprensivi delle valutazioni effettuate da parte del Settore HTA e delle commissioni consultive dell’Agenzia; infine il tempo di trasmissione in Gazzetta Ufficiale, misura i giorni dalla data di approvazione da parte del CdA, compresa la determina e la condivisione con le aziende, fino alla trasmissione del provvedimento di rimborsabilità e prezzo del farmaco in Gazzetta Ufficiale.
Il tempo intercorso tra la data del parere del CHMP e la data della decisione della Commissione Europea (CE), nel periodo 2018-2021, si è attestato essere in media intorno ai 2 mesi per i farmaci non generici e tra i 2-3 mesi per i farmaci generici, con una variabilità maggiore per le procedure relative a farmaci non generici.
Il tempo intercorso tra la data della decisione della Commissione Europea (CE) e la data di presentazione dell’istanza di P&R da parte dell’azienda farmaceutica si è osservato essere, dal 2018 al 2020, in media dai 10 ai 12 mesi per i farmaci non generici e dai 7 mesi e ai 12 mesi per i farmaci generici, presentando una forte variabilità nel tempo per entrambe le categorie farmaceutiche.
Il tempo di verifica amministrativa è risultato essere l’indicatore più ottimale, con un valore medio nel periodo 2018-2021 pari a 8 giorni e riducendosi sempre di più nell’arco temporale fino a 2 giorni per i farmaci generici e 5 giorni per i farmaci non generici nel 2021.
La durata complessiva del procedimento – dalla data di avvio alla data di conclusione, includendo i tempi di valutazione da parte delle commissioni consultive dell’Agenzia (Segretariato HTA, Commissione Tecnico Scientifica e Comitato Prezzi e Rimborso) – è diminuita dal 2018 al 2020 passando in media da 9 a 8 mesi per i farmaci non generici e intorno ai 3 mesi per i farmaci generici.
 Il tempo di trasmissione in Gazzetta Ufficiale, dalla data di conclusione del procedimento fino alla trasmissione in Gazzetta Ufficiale del relativo provvedimento, si è osservata in diminuzione nel tempo passando da poco più di 2 mesi nel 2018 a 2 mesi nel 2020, sia per i farmaci generici sia per i farmaci non generici.
Il tempo di trasmissione in Gazzetta Ufficiale, dalla data di conclusione del procedimento fino alla trasmissione in Gazzetta Ufficiale del relativo provvedimento, si è osservata in diminuzione nel tempo passando da poco più di 2 mesi nel 2018 a 2 mesi nel 2020, sia per i farmaci generici sia per i farmaci non generici.
I dati emersi dall’analisi sono stati poi confrontati con le tempistiche dei principali paesi europei riportate in uno studio internazionale recentemente pubblicato (“EFPIA patients W.A.I.T. Indicator 2021 survey”, IQVIA, aprile 2022). Dal confronto emerge che le tempistiche di AIFA sono da ritenersi soddisfacenti, infatti l’Italia si posiziona tra i primi paesi europei in ambito di autorizzazione dei medicinali, con valore medio pari a 429 giorni rispetto a una media europea di 511 giorni e a fronte di un elevato numero di farmaci totalmente rimborsati dal Servizio sanitario nazionale.
Il periodo di analisi del presente studio include due anni di attività svolta dovendo fronteggiare l’emergenza COVID-19.
La metodologia di analisi utilizzata nello studio offrirà, inoltre, all’Agenzia uno strumento di monitoraggio continuo della propria azione amministrativa, relativa all’attività di rimborsabilità e prezzo dei farmaci, con l’obiettivo finale di ottimizzare le proprie tempistiche e rendere tempestivamente accessibili i farmaci ai pazienti.
Pubblicato il: 13 aprile 2022
Presentazione [0.74 Mb] [PDF] >