
La valutazione di equivalenza terapeutica tra farmaci coperti da brevetto e altri a brevetto scaduto, senza la necessaria evidenza scientifica, rappresenta un chiaro indebolimento della  tutela brevettuale. Parla Fabrizio Greco, presidente dell’Italian american pharmaceutical group (Iapg)
tutela brevettuale. Parla Fabrizio Greco, presidente dell’Italian american pharmaceutical group (Iapg)
formiche – 5 luglio 2019 – di Fabrizio Greco
Il brevetto per invenzione è un istituto giuridico che assicura all’autore il diritto di utilizzazione esclusiva dell’oggetto del brevetto per vent’anni dalla data di deposito della domanda, ed è volto a impedire a terzi di produrlo, usarlo, metterlo in commercio, venderlo o importarlo, salvo se con il consenso del titolare. Esistono determinati requisiti che deve possedere un’invenzione industriale per poter ottenere la tutela brevettuale, nel dettaglio: novità, attività inventiva, applicabilità industriale, liceità e ripetibilità.
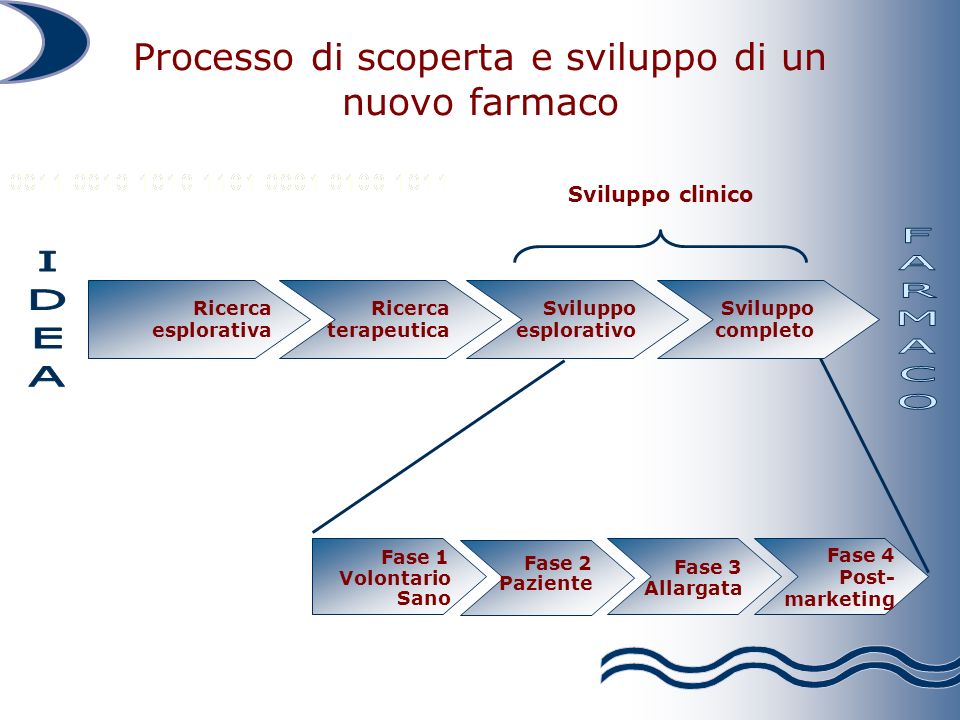
Il farmaceutico è uno degli ambiti in cui il brevetto trova la sua massima applicazione perché la ricerca di nuovi farmaci è l’attività fondante del settore e la finalità è quella di permettere di recuperare le ingenti risorse necessarie per lo sviluppo di un nuovo medicinale e vedere riconosciuto e valorizzato l’impegno e i rischi sottesi alle diverse fasi della ricerca. Si consideri, inoltre, che il brevetto farmaceutico decorre dal momento in cui ne viene chiesto il diritto esclusivo di utilizzazione che, di regola, avviene sin dalle prime fasi di avvio della ricerca. Il periodo che intercorre dalla suddetta fase di avvio della ricerca fino al rilascio dell’autorizzazione alla commercializzazione di un nuovo farmaco e alla definizione del prezzo comporta una considerevole riduzione del tempo di utilizzazione dell’invenzione.
In pratica, su vent’anni di tutela brevettuale, alle imprese del farmaco restano circa otto anni di commercializzazione per recuperare gli investimenti. In questo contesto, qual è la posizione  dell’Italia sul brevetto farmaceutico? Il valore del brevetto per il progresso scientifico e tecnico in ossequio all’art. 9 della Costituzione sembrerebbe rappresentare una consapevolezza consolidata nel nostro Paese: già nel 1978 infatti il divieto di brevettazione dei farmaci è stato dichiarato incostituzionale. Guardando a tempi più recenti, è notizia di queste settimane che il nostro Paese è impegnato in un’iniziativa politico-istituzionale, sostenuta trasversalmente da tutti i partiti, per promuovere la candidatura dell’Italia per l’assegnazione alla città di Milano della sede del Tribunale europeo unificato dei brevetti, in particolare della sezione specializzata sulle controversie in tema di chimica farmaceutica e scienze della vita.
dell’Italia sul brevetto farmaceutico? Il valore del brevetto per il progresso scientifico e tecnico in ossequio all’art. 9 della Costituzione sembrerebbe rappresentare una consapevolezza consolidata nel nostro Paese: già nel 1978 infatti il divieto di brevettazione dei farmaci è stato dichiarato incostituzionale. Guardando a tempi più recenti, è notizia di queste settimane che il nostro Paese è impegnato in un’iniziativa politico-istituzionale, sostenuta trasversalmente da tutti i partiti, per promuovere la candidatura dell’Italia per l’assegnazione alla città di Milano della sede del Tribunale europeo unificato dei brevetti, in particolare della sezione specializzata sulle controversie in tema di chimica farmaceutica e scienze della vita.
Elementi, quelli richiamati, che sembrerebbero suffragare la suddetta consapevolezza da parte dell’Italia del valore imprescindibile del brevetto per lo sviluppo del settore delle scienze della vita, di cui il farmaceutico è un pilastro fondante. Una lettura diversa, meno entusiasta, emerge invece da un’analisi più attenta dei recenti dibattiti sulle modifiche alle politiche di settore annunciate dal governo alla fine dello scorso anno. In  particolare, emerge con chiarezza come molte delle misure in discussione rischino di vanificare il valore della tutela brevettuale. Tra queste, la possibilità per le Regioni di richiedere all’Agenzia italiana del farmaco (Aifa) di esprimersi sulla sussistenza di equivalenza terapeutica tra medicinali contenenti princìpi attivi tra loro differenti, anche a brevetto scaduto, per procedere all’implementazione delle gare regionali in equivalenza, senza richiedere esplicitamente che l’eventuale equivalenza terapeutica sia scientificamente dimostrata per tutte le tipologie di pazienti.
particolare, emerge con chiarezza come molte delle misure in discussione rischino di vanificare il valore della tutela brevettuale. Tra queste, la possibilità per le Regioni di richiedere all’Agenzia italiana del farmaco (Aifa) di esprimersi sulla sussistenza di equivalenza terapeutica tra medicinali contenenti princìpi attivi tra loro differenti, anche a brevetto scaduto, per procedere all’implementazione delle gare regionali in equivalenza, senza richiedere esplicitamente che l’eventuale equivalenza terapeutica sia scientificamente dimostrata per tutte le tipologie di pazienti.
Prevedere la valutazione di equivalenza terapeutica tra farmaci coperti da brevetto e altri a brevetto scaduto, senza la necessaria evidenza scientifica, rappresenta un chiaro indebolimento della tutela brevettuale, con il conseguente disincentivo agli investimenti in ricerca e sviluppo in quanto un tale scenario non consentirebbe ai nuovi farmaci la previsione di trovare un adeguato ritorno delle risorse impiegate, così da poter essere utilizzate per la scoperta di future terapie innovative. È evidente infatti che la decisione se procedere nello sviluppo di un nuovo farmaco avviene molti anni prima della generazione dell’evidenza che tale medicinale porti o meno un valore terapeutico aggiunto rispetto alle opzioni di trattamento disponibili.
Se al rischio oggettivo di fallimento delle ipotesi della ricerca clinica, si dovesse sommare l’incertezza sulla valutazione, non scientifica ma economicistica, dell’equivalenza terapeutica tra princìpi attivi diversi e a prescindere dalla copertura brevettuale, risulterebbero drasticamente ridotte le aspettative di ritorno economico dell’investimento, con conseguente riduzione delle opportunità di sviluppo di nuove terapie. Sviluppare quindi modelli che, nel tentativo di ottenere benefici economici di breve termine, mettano a repentaglio il valore della tutela brevettuale, e quindi di fatto disincentivino la ricerca di nuovi farmaci, sarebbe quindi controproducente dal punto di vista scientifico ed economico e, soprattutto, nella prospettiva dei pazienti, che attendono dalla ricerca trattamenti innovativi per bisogni terapeutici non soddisfatti.
È fondamentale che l’innovazione sia supportata da adeguate misure, regole certe e stabili, per assicurare il progresso della ricerca a beneficio della salute delle persone. L’Italia, negli anni, ha operato nel pieno rispetto della tutela brevettuale e, dal 1951 a oggi, l’aspettativa di vita è cresciuta di ben 17 anni, stimolando inoltre la ricerca e rafforzando il valore scientifico, economico e industriale del nostro Paese. In tale prospettiva, emerge la necessità di una governance di settore che riconosca il valore scientifico e terapeutico della scoperta e che, attraverso la tutela del brevetto, incentivi la ricerca di nuove terapie che consentano di affrontare efficacemente i bisogni di salute ancora non soddisfatti, oltre a raccogliere i benefici economici derivanti dallo sviluppo delle conoscenze scientifiche e da un Paese in migliore salute.





