Key points
- Il programma PreCheck mira a rafforzare la catena di approvvigionamento farmaceutico degli Stati Uniti semplificando le valutazioni normative per gli impianti di produzione nazionali.
- L’iniziativa incoraggia l’onshoring fornendo prevedibilità normativa e coinvolgimento precoce, accelerando lo sviluppo e la valutazione delle strutture.
- La selezione per il programma è competitiva, concentrandosi sul tipo di prodotto, sulla fase di sviluppo e sull’innovazione, con attività a partire dal 2026.
- Il feedback del settore ha influenzato in modo significativo la progettazione del programma, evidenziando l’importanza dell’impegno precoce e dei processi di documentazione semplificati.
 Il programma pilota PreCheck è progettato per rafforzare la catena di approvvigionamento farmaceutico degli Stati Uniti aumentando la prevedibilità normativa e semplificando la valutazione dei nuovi siti di produzione nazionali.
Il programma pilota PreCheck è progettato per rafforzare la catena di approvvigionamento farmaceutico degli Stati Uniti aumentando la prevedibilità normativa e semplificando la valutazione dei nuovi siti di produzione nazionali.
La FDA ha lanciato ufficialmente il suo programma pilota PreCheck, che è progettato per rafforzare la catena di approvvigionamento farmaceutico nazionale semplificando il processo di valutazione normativa per gli impianti di produzione con sede negli Stati Uniti. Fornendo una maggiore prevedibilità normativa e un impegno precoce, il programma mira a facilitare la costruzione di siti nazionali e accelerare la valutazione degli elementi di produzione prima ancora che venga presentata una domanda di prodotto specifica.
Si tratta di un cambiamento strategico verso l’onshore?
Il commissario della FDA Marty Makary, M.D., M.P.H., ha descritto il programma come un “passo audace” per riportare la produzione negli Stati Uniti e rendere il settore interno più resiliente e competitivo. Questo programma si posiziona come uno dei numerosi incentivi che l’agenzia sta implementando per rafforzare l’offerta di farmaci nazionali.
“Dopo 35 anni di globalisti che portano la produzione farmaceutica all’estero, la FDA sta facendo passi coraggiosi per riportarla indietro”, ha detto il commissario della FDA Marty Makary, M.D., M.P.H, nel comunicato stampa. “Il programma PreCheck è uno dei numerosi potenti incentivi che stiamo fornendo per rendere il settore manifatturiero farmaceutico statunitense più resiliente e competitivo”.
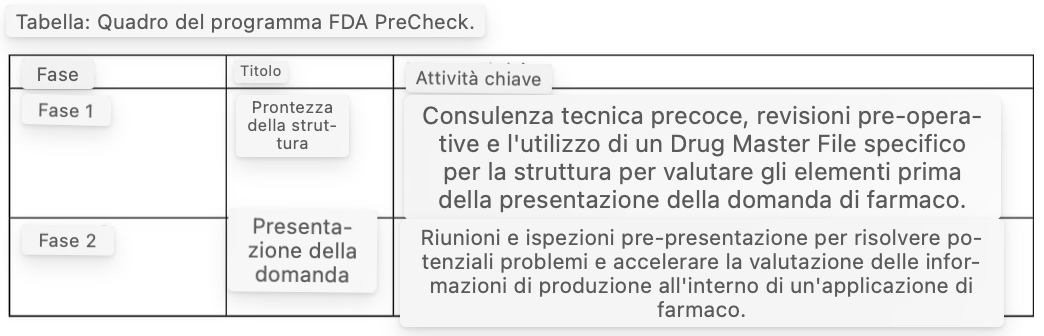
Il quadro a due fasi
Il programma PreCheck è strutturato in due fasi distinte per garantire un supporto completo durante tutto il ciclo di vita dello sviluppo della struttura (vedi Table).
 Quali sono i criteri di selezione?
Quali sono i criteri di selezione?
L’agenzia inizierà a condurre attività PreCheck con una coorte iniziale di nuove strutture nel 2026. La selezione per il programma è competitiva e si basa sull’allineamento con le priorità nazionali.
La FDA valuterà i candidati in base ai seguenti criteri:
• Tipo di prodotto. Le strutture che producono farmaci critici per il mercato statunitense riceveranno una considerazione prioritaria.
• Fase di sviluppo. L’attuale fase di sviluppo delle strutture e la tempistica prevista per raggiungere il mercato statunitense.
• Innovazione. Un focus su approcci innovativi allo sviluppo delle strutture e ai processi di produzione.
Che ruolo ha svolto il feedback del settore?
Il design di PreCheck non è un mandato dall’alto verso il basso, ma un riflesso di un’ampia collaborazione industriale, secondo l’agenzia. La FDA ha incorporato il feedback di una riunione pubblica tenutasi il 30  settembre 2025, intitolata “Produzione onshore di farmaci e prodotti biologici”. Le parti interessate del settore hanno espresso un forte sostegno per l’impegno precoce durante lo sviluppo delle strutture e l’implementazione di processi di documentazione semplificati, entrambi i quali sono ora componenti fondamentali del modello PreCheck.
settembre 2025, intitolata “Produzione onshore di farmaci e prodotti biologici”. Le parti interessate del settore hanno espresso un forte sostegno per l’impegno precoce durante lo sviluppo delle strutture e l’implementazione di processi di documentazione semplificati, entrambi i quali sono ora componenti fondamentali del modello PreCheck.
Cosa significa questo per i produttori?
Gli sforzi di onshoring possono essere guidati dalla necessità di mitigare i rischi associati alla logistica globale e alle catene di approvvigionamento “just-in-time”. Le aziende che desiderano stabilire nuovi impianti di produzione API possono affrontare ostacoli normativi tra cui la prevedibilità delle ispezioni e la flessibilità post-approvazione.
I produttori interessati a partecipare al programma 2026 dovrebbero rivedere i criteri di ammissibilità e selezione sulla pagina web ufficiale FDA PreCheck. L’agenzia sta attualmente accettando richieste di partecipazione a tare dal 1° febbraio 2026.
References
- FDA. La FDA lancia il programma pilota PreCheck per rafforzare la produzione farmaceutica nazionale. Comunicato stampa. 1 febbraio 2026. https://www.fda.gov/news-events/press-announcements/fda-launches-precheck-pilot-program-strengthen-domestic-pharmaceutical-manufacturing
- Schwartz, M.I. e Kim, J. Produzione di farmaci onshore. Approfondimenti dall’iniziativa PreCheck e dall’incontro pubblico della FDA. TheFDALawBlog.com. Ottobre. 28, 2025. https://www.thefdalawblog.com/2025/10/onshoring-drug-manufacturing-insights-from-fdas-precheck-initiative-and-public-meeting
Related news: FDA Public Meeting: Onshoring Manufacturing of Drugs and Biological Products
Nota FDA
Fino agli anni 2000, la produzione farmaceutica era in gran parte un’impresa domestica. Negli ultimi decenni, tuttavia, tale produzione si è sempre più spostata all’estero. Oggi, più della metà dei prodotti farmaceutici distribuiti negli Stati Uniti sono prodotti all’estero. A partire dal 2025, circa il 53% dei prodotti  farmaceutici di marca e il 69% dei prodotti farmaceutici generici sono fabbricati al di fuori degli Stati Uniti. A partire dal 2025, solo il 9% dei produttori di API si trova negli Stati Uniti. S., rispetto al 22% in Cina e al 44% in India.
farmaceutici di marca e il 69% dei prodotti farmaceutici generici sono fabbricati al di fuori degli Stati Uniti. A partire dal 2025, solo il 9% dei produttori di API si trova negli Stati Uniti. S., rispetto al 22% in Cina e al 44% in India.
Per contribuire a rafforzare la resilienza della catena di approvvigionamento farmaceutico negli Stati Uniti, il 5 maggio 2025, il Presidente ha emesso l’Ordine Esecutivo (EO) 14293, “Sgravi normativi per promuovere la produzione interna di medicinali critici”. L’EO 14293 stabilisce una politica intesa a semplificare la regolamentazione della produzione di prodotti farmaceutici per facilitare il ripristino di una solida base farmaceutica nazionale. EO 14293 ordina alla FDA di rivedere i regolamenti e le linee guida esistenti relativi allo sviluppo della produzione farmaceutica nazionale e adottare misure per “eliminare eventuali requisiti duplicati o non necessari…; massimizzare la tempestività e la prevedibilità della revisione dell’agenzia; e semplificare e accelerare lo sviluppo della produzione farmaceutica nazionale”.
In risposta all’EO 14293, la FDA ha sviluppato una proposta, FDA PreCheck per accelerare l’istituzione di nuovi impianti di produzione farmaceutica ad alta priorità negli Stati Uniti e rafforzare la catena di approvvigionamento farmaceutico nazionale. In particolare, la proposta consiste in un approccio in due fasi: (1) Fase di preparazione della struttura e (2) Fase di presentazione della domanda.