Trasparenza sui passaggi di denaro da Big Pharma ai medici: perché fa paura il Sunshine Act italiano?
È in corso di esame alla Commissione Affari Sociali della Camera la proposta di legge che introduce l’obbligo di trasparenza nei passaggi di denaro tra aziende farmaceutiche e medici. Tra le organizzazioni e le associazioni del settore c’è chi è completamente favorevole e chi esprime anche “timori”…
Il cambiamento – 3 dicembre 2018
È all’esame della Commissione Affari Sociali della Camera la proposta di legge soprannominata “Sunshine Act italiano”, dal testo di legge analogo vigente in America che detta le regole per la trasparenza nel passaggio i denaro tra Big Pharma e gli operatori sanitari.
L’associazione “No Grazie Pago io” (operatori sanitari e medici che rifiutano qualsiasi erogazione dalle aziende farmaceutiche) ha partecipato alle audizioni davanti alla Commissione come parte della delegazione della Rete Sostenibilità e Salute (RSS), collaborando alla stesura e alla presentazione di una memoria messa agli atti dalla commissione.
«La nostra memoria – spiegano i NoGrazie – guarda con favore alla proposta di legge per un Sunshine Act italiano; chiede che l’iter per la sua approvazione sia rapido e che siano presi in considerazione altri attori, oltre a industria del farmaco e medici, per esempio l’industria degli alimenti per l’infanzia e le associazioni di pazienti». Anche Slow Medicine faceva parte della delegazione RSS; la loro memoria è leggibile HERE
Le audizioni hanno riguardato anche altri soggetti.
La FNOMCEO, per esempio, ha sottolineato che “il Codice di deontologia medica già prevede apposite disposizioni in materia di conflitto di interessi” e che “il Codice di comportamento dei dipendenti pubblici … prevede che il dipendente pubblico deve rispettare i principi di integrità, correttezza, buona fede, proporzionalità, obiettività, trasparenza, equità e ragionevolezza e agire in posizione di indipendenza e imparzialità, astenendosi in caso di conflitto di interessi”, ma “al tempo stesso non possiamo accettare che passi una cultura di criminalizzazione e di pregiudizio nei confronti della intera categoria professionale medica. Noi crediamo che eventuali strumentalizzazioni possano incrinare il rapporto di fiducia che esiste tra medico e paziente e non siano funzionali al sistema salute”.
La proposta di legge per il Sunshine Act, tuttavia, riguarda solo la trasparenza delle transazioni finanziarie tra industria e medici, senza criminalizzare o strumentalizzare nessuno. Anche la Fondazione GIMBE ha partecipato alle audizioni, facendo un appello ad “evitare di demonizzare i trasferimenti di denaro, che non necessariamente sono correlati a fenomeni corruttivi”.
 «Rispettiamo ovviamente tutte le posizioni – dicono i NoGrazie – ma non capiamo perché la trasparenza incuta tanti timori».
«Rispettiamo ovviamente tutte le posizioni – dicono i NoGrazie – ma non capiamo perché la trasparenza incuta tanti timori».
Ecco il testo della Memoria presentata dalla Rete Sostenibilità e Salute.
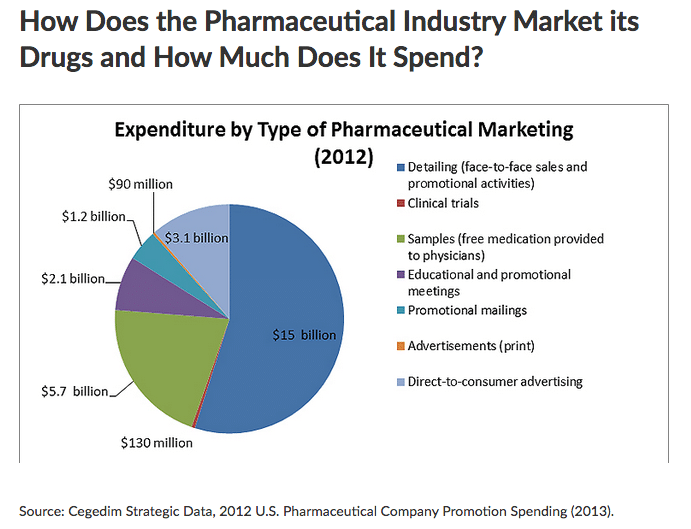
«Nel 2012, negli USA, l’industria farmaceutica ha speso circa 27 miliardi di dollari in promozione, di cui 3 per la promozione diretta al pubblico e 24 per quella diretta ai medici (1). Dato che la spesa totale per farmaci è di circa 300 miliardi di dollari, la promozione rivolta ai medici vale circa l’8% di questa spesa. Non è facile, e forse non è nemmeno possibile, trovare dati sulla spesa per la promozione ai medici in Italia. Ma se la percentuale fosse simile a quella USA, si tratterebbe di circa 2.4 miliardi di euro su una spesa annuale per farmaci che si aggira sui 30 miliardi. E stiamo parlando solo di farmaci, ai quali bisogna sommare la spesa per la promozione di tutti gli altri dispositivi sanitari, per la diagnostica, per terapie non farmacologiche di vario tipo, per la riabilitazione, per la nutrizione (compresa quella infantile), ecc.
Come sono spesi questi 2.4 miliardi di euro? Difficile saperlo, ma dato che l’industria farmaceutica è globale, sono probabilmente globali anche le strategie di marketing. La torta, quindi, non sarà molto diversa da quella degli USA, nella figura qui sopra. Circa la metà dei soldi potrebbero essere spesi per le attività dei rappresentanti, solo in Italia chiamati informatori scientifici. Altre fette importanti riguardano la distribuzione di campioni, il finanziamento di eventi formativi e la spedizione di materiale promozionale di vario tipo. Vale la pena notare che a pagare per tutto ciò sono i cittadini, visto che la spesa per marketing è sicuramente integrata nel prezzo dei farmaci, sia che lo paghi direttamente il consumatore sia che lo finanzi il sistema sanitario nazionale (SSN).
 Che la spesa per marketing dia un ritorno è più che certo. Nessun amministratore delegato potrebbe essere confermato da un’assemblea annuale di azionisti se non potesse dimostrare che per ogni euro speso in marketing ne introita 2 o 3 (questa è una stima, perché non ci sono dati a disposizione, ma è una stima considerata verosimile). Questo ritorno si basa ovviamente su un aumento di vendite dei prodotti oggetto di promozione commerciale. Una revisione sistematica pubblicata nel 2017 mostra che le attività mostrate nella figura qui sopra sono invariabilmente associate a un aumento delle prescrizioni (in media di due volte e mezza), spesso inappropriate e di minore qualità, e a un aumento relativo dei costi (2). Prescrizioni con percentuali più elevate di farmaci ancora sotto brevetto rispetto alle alternative equivalenti. Non stupisce che la spesa per il marketing possa superare anche di due o tre volte quella per la ricerca e lo sviluppo di nuovi farmaci (3).
Che la spesa per marketing dia un ritorno è più che certo. Nessun amministratore delegato potrebbe essere confermato da un’assemblea annuale di azionisti se non potesse dimostrare che per ogni euro speso in marketing ne introita 2 o 3 (questa è una stima, perché non ci sono dati a disposizione, ma è una stima considerata verosimile). Questo ritorno si basa ovviamente su un aumento di vendite dei prodotti oggetto di promozione commerciale. Una revisione sistematica pubblicata nel 2017 mostra che le attività mostrate nella figura qui sopra sono invariabilmente associate a un aumento delle prescrizioni (in media di due volte e mezza), spesso inappropriate e di minore qualità, e a un aumento relativo dei costi (2). Prescrizioni con percentuali più elevate di farmaci ancora sotto brevetto rispetto alle alternative equivalenti. Non stupisce che la spesa per il marketing possa superare anche di due o tre volte quella per la ricerca e lo sviluppo di nuovi farmaci (3).
La RSS ritiene che, ai fini della sostenibilità del SSN, sia necessario regolare in maniera restrittiva il marketing dei farmaci e di tutti gli altri dispositivi sanitari e tecnologie diagnostiche, con l’obiettivo di ridurre l’eccesso, spesso inutile o dannoso, e in ogni caso costoso, di prestazioni sanitarie (4). Ma per regolare il marketing, bisogna conoscerlo. È quindi necessario, in primo luogo, sapere nel modo più accurato possibile come l’industria della salute spende i soldi che investe per la promozione rivolta ai medici e ad altri operatori sanitari. Per questo, la RSS è favorevole al Sunshine Act (usiamo questo termine per brevità e perché è ormai entrato nel linguaggio comune di chi si occupa di questi temi), una legge che imponga trasparenza su tutte le transazioni finanziarie (in denaro, beni o servizi) tra produttori di farmaci, dispositivi medici o altri prodotti sanitari e operatori, associazioni e istituzioni sanitarie.
Per essere efficace, questa legge deve avere, secondo la RSS, le seguenti caratteristiche:
• obbligare a notificare tutte le transazioni finanziarie, di qualsiasi tipo e per qualsiasi valore che superi i 10 euro per singola transazione, o i 100 euro annuali nel caso di ripetute transazioni di scarso valore.
• imporre severe sanzioni in caso di mancata notificazione, o di tentativi di aggirare la legge (per esempio con transazioni in nero, o a prestanome, o su conti esteri, ecc.).
• inserire tutte le transazioni, con dati identificativi da stabilire (compresa la ragione di ogni transazione) in un registro pubblico che possa essere facilmente consultabile e analizzabile da chiunque, dai semplici cittadini ai rappresentanti delle istituzioni, passando per ricercatori e giornalisti.
Dovrebbe inoltre applicarsi a transazioni finanziarie da parte di qualsiasi industria in qualche modo relazionata con la salute. Per esempio, molte attività educative e di ricerca dei pediatri sono sponsorizzate, oltre che dai produttori di farmaci e vaccini, da quelli di alimenti per l’infanzia (Nestlé, Mellin/Danone, Plasmon, Humana, ecc.), con conseguenze negative su inizio, esclusività e durata dell’allattamento, e relativi danni alla salute di madri e bambini (5,6). Queste transazioni devono essere coperte dalla legge. Infine, dovrebbero ricadere nell’ambito della legge anche le transazioni nei confronti delle associazioni di pazienti; alcune di queste sono infatti finanziate dall’industria farmaceutica che ne approfitta per promuovere l’uso dei suoi prodotti (7).
È fattibile mettere in pratica un Sunshine Act italiano? Il fatto che una legge simile sia già applicata in altri paesi da alcuni anni depone a favore di una risposta positiva a questa domanda. Come si sa, il Sunshine Act è in vigore dal 2011 negli USA ed include attualmente informazioni sulle transazioni di oltre 2000 ditte con oltre 900.000 medici, per un totale annuale di circa 25 miliardi di dollari (8). Ha permesso a ricercatori accademici, per esempio, di analizzare i flussi finanziari a seconda della specializzazione dei medici (9,10). Ha permesso ad associazioni per la difesa dei diritti dei cittadini di comprovare che i medici che ricevono più soldi dall’industria farmaceutica tendono a prescrivere più farmaci di marca (11). Ha permesso a giornalisti di scoprire che un famoso oncologo di New York aveva omesso di dichiarare i suoi conflitti d’interesse, del valore di oltre 3 milioni di dollari, nel firmare articoli per importanti riviste scientifiche e nel promuovere specifiche terapie per il carcinoma del seno in numerosi congressi, terapie che avevano alternative meno costose e che si sarebbero per di più rivelate di scarsa validità. L’oncologo ha dovuto rassegnare le dimissioni dopo che il New York Times ha svelato i suoi legami con l’industria (12).
Leggi simili al Sunshine Act USA sono in vigore da alcuni anni anche in alcuni paesi dell’Unione Europea: Francia, Portogallo, Danimarca, Grecia, Romania, Lituania e, ultimo arrivato, Belgio. La legge francese è più ampia di quella statunitense e ha dei criteri di notificazione più stringenti, ma le multe in caso di inadempienze sono minori (13). Sfortunatamente, oltre ai rapporti annuali dell’amministrazione francese sui dati inseriti nel registro, non sono disponibili articoli che analizzino volumi e distribuzione dei pagamenti ai medici. Considerazioni simili  valgono per le leggi negli altri paesi citati dell’Unione Europea (14).
valgono per le leggi negli altri paesi citati dell’Unione Europea (14).
Anche se è presto, eccetto per USA e Francia, per un giudizio sulla fattibilità di un Sunshine Act, tutte le informazioni che abbiamo finora a disposizione tendono verso una risposta positiva. Anche l’Unione Europea sembra convinta della fattibilità della legge, visto che, attraverso il Progetto Anticorruzione e Trasparenza, ha finanziato in Colombia l’elaborazione del Sunshine Act, e del relativo registro pubblico delle notificazioni (15). Se si può fare in Colombia, è molto probabile che si possa fare anche in Italia.
Ci sono alternative? Alcune multinazionali del farmaco, come per esempio la GlaxoSmithKline, hanno dichiarato l’impegno a una totale trasparenza, in alcuni paesi, nei riguardi delle loro transazioni finanziarie con medici e altri operatori sanitari. Un simile impegno, a livello europeo, è stato preso da EFPIA (la Federazione Europea delle Industrie e delle Associazioni Farmaceutiche) nel 2013. Si tratta di un codice etico volontario, sia per le ditte sia per i medici, che facilita la pubblicazione delle transazioni finanziarie su qualche tipo di registro privato, cioè di proprietà delle ditte. Questa proposta è stata fatta propria in Italia da Assobiomedica (16). Peccato che non funzioni.
Innanzitutto perché il fatto che sia volontario, e non obbligatorio, rende la trasparenza incompleta per definizione. Poi perché la consultazione e l’analisi dei database è praticamente impossibile: i dati sono in formato pdf, a volte non si può nemmeno scaricare un file pdf ma si deve procedere a forza di screenshot, in alcuni casi i dati sono in ordine alfabetico per nome e in altri per cognome, in altri casi nomi e cognomi sono preceduti da prof e dott (per cui è impossibile seguire un ordine alfabetico), raramente si riesce a scaricare i dati in un formato analizzabile (tipo excel), per cui si dovrebbe copiarli uno a uno. Si immagini il tempo di lavoro che ciò comporterebbe se si volessero analizzare le transazioni finanziarie delle oltre 200 imprese che operano in Italia (17).
L’inferiorità di un sistema basato su codici volontari rispetto ad uno ispirato al Sunshine Act è stata recentemente confermata da uno studio che ha condotto un’analisi comparata in 9 paesi europei: Francia, Germania, Olanda, Gran Bretagna, Lettonia, Svezia, Spagna, Portogallo e Italia.18 Oltre alla completezza, sempre superiore nei sistemi di legge rispetto a quelli volontari, lo studio conferma la difficoltà di accedere e soprattutto di analizzare i dati in questi ultimi. Gli autori raccomandano un Sunshine Act europeo che standardizzi i registri sulle transazioni finanziarie tra industria e medici in tutti i paesi, facilitando così il compito di cittadini, giornalisti, associazioni, ricercatori e istituzioni che desiderino analizzare i dati per semplice curiosità o per capire se e come porre dei limiti a questo enorme passaggio di denaro, per ridurne le conseguenze dannose.
In conclusione, la RSS è a favore di una legge come il Sunshine Act, purché sia efficace, risponda cioè alle caratteristiche sopra elencate. La RSS, tuttavia, ritiene che il Sunshine Act non risolva tutti i problemi. Dopo i primi due anni di funzionamento negli USA, per esempio, non ha (ancora) portato a una riduzione delle transazioni finanziarie né in quantità né in valore (19).
Il Sunshine Act rende solo trasparenti queste transazioni, permette di sapere quanto denaro passa di mano, da chi a chi e per quali ragioni. Permette di identificare i conflitti di interesse finanziari creati da queste transazioni. Potrebbe avere effetti a medio termine, come conseguenze di scelte di consumatori più consapevoli, raggiunti da informazioni più trasparenti relative a produttori ed erogatori di prestazioni sanitarie. Ma in ogni caso, alla fin fine, spetterà al legislatore e a chi amministra il SSN, auspicabilmente su pressione di gruppi di cittadini, decidere se transazioni e conflitti d’interesse stanno causando danni alla salute dei cittadini e alla sostenibilità del sistema, ed agire di conseguenza con altri interventi
2 Brax H et al. Association between physicians’ interaction with pharmaceutical companies and their clinical practices: A systematic review and meta-analysis. PLoS ONE 2017;12(4): e0175493
3 Gagnon MA, Lexchin J: The cost of pushing pills: a new estimate of pharmaceutical promotion expenditures in the United States. PLoS Med 2008;5(1):e1
5 Piwoz EG, Huff man SL. The impact of marketing of breast-milk substitutes on WHO-recommended breastfeeding practices. Food Nutr Bull 2015;36:373-86
6 McFadden A et al. Spotlight on infant formula: coordinated global action needed. Lancet 2016;387:413-5
7 McCoy MS. Industry support of patient advocacy organizations: the case for an extension of the Sunshine Act provisions of the Affordable Care Act. Am J Public Health 2018; 108:1026-30
8 Litman RS. The Physician Payments Sunshine Act: implications and predictions. Pediatrics 2018;141: e20171551
9 Agrawal S, Brown D. The Physician Payments Sunshine Act: two years of the open payments program. N Eng J Med 2016;374:906-9
10 Parikh K et al. Industry relationships with pediatricians: findings from the open payments Sunshine Act. Pediatrics 2016;137:e20154440
11 Ornstein C et al. Now there’s proof: docs who get company cash tend to prescribe more brand name meds. ProPublica, 17 March 2016
12 Top cancer researcher fails to disclose corporate financial ties in major research journals. By Charles Ornstein and Katie Thomas, New York Times, September 8, 2018
14 Santos A. The sun shines on Europe: transparency of financial relationships in the healthcare sector. Health Action International, Amsterdam, 2017
15 https://www.minsalud.gov.co/Paginas/Farmaceuticas-deberan-reportar-pagos-a-actores-del-sistema.aspx
17 https://www.aboutpharma.com/blog/2017/02/22/458650/