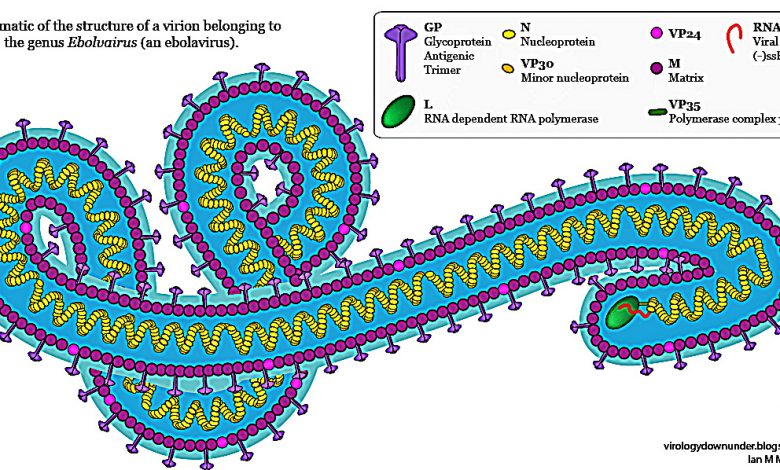
Falso allarme Ebola in Italia.Ebola. L’OMS valuta l’uso di farmaci sperimentali in Africa. Intanto il numero dei morti sale a 932
Verrà istituito un team di esperti che valuterà gli aspetti etici della vicenda. L’epidemia di ebola in Africa occidentale – riferisce l’Oms – ha contagiato già 1.711 persone, 932 di queste sono morte. Il ‘siero’ somministrato ai due missionari americani contagiati in Liberia non era mai stato usato prima con gli esseri umani, ma aveva dato buoni risultati sulle scimmie. Viene prodotto con la pianta del tabacco.
Ginevra (Svizzera)
E’ sempre più emergenza ebola. I dati sono allarmanti: l’Organizzazione mondiale della Sanità ha riferito che i casi di contagio in Africa occidentale sono ormai già a quota 1.711 e 932 di questi hanno avuto come esito la morte. Dal 2 al 4 agosto, nei quattro Paesi interessati dall’epidemia – Guinea Conakry, Liberia, Sierra Leone e Nigeria – ci sono stati 108 casi nuovi e 45 decessi.
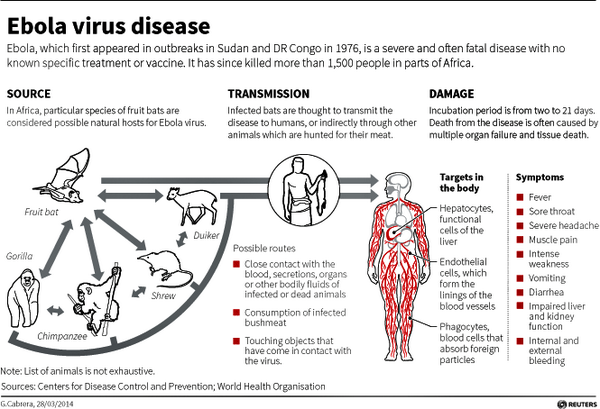 Non c’è più tempo, quindi. La massima autorità sanitaria mondiale ha infatti ha annunciato che valuterà l’uso di farmaci sperimentali per combattere l’epidemia del virus letale. In un comunicato l’agenzia Onu fa sapere che a partire dall’inizio della prossima settimana verrà istituito un panel di esperti incaricato di valutare gli aspetti etici della vicenda.
Non c’è più tempo, quindi. La massima autorità sanitaria mondiale ha infatti ha annunciato che valuterà l’uso di farmaci sperimentali per combattere l’epidemia del virus letale. In un comunicato l’agenzia Onu fa sapere che a partire dall’inizio della prossima settimana verrà istituito un panel di esperti incaricato di valutare gli aspetti etici della vicenda.
E anche il presidente degli Stati Uniti, Barack Obama ha riferito di non avere abbastanza informazioni sul nuovo farmaco ant-ebola: “Non ho abbastanza informazioni per considerare la procedura accelerata per l’approvazione”, ha detto. Ma è certo che il virus “si può controllare e contenere”. Il presidente ha però definito “prematuro” ricorrere all’uso di un farmaco sperimentale da
inviare in Africa per combattere il virus e la sua diffusione. Il leader della Casa Bianca ha poi ricordato che ammontano a 37 miliardi di dollari gli investimenti americani in Africa.
Circa il nuovo farmaco, si parla del cosiddetto ‘siero miracoloso’, (vedi Zmapp, ndr) quel farmaco sperimentale grazie al quale sarebbero migliorate le condizioni dei due missionari della Samaritan’s Purse Kent Brantley e Nancy Writebol ammalatisi in Liberia e ricoverati al centro sperimentale Usa di Atlanta per le cure. I due missionari, ora in isolamento, sono stati trattati con il ritrovato medico che avrebbe dato buoni risultati già a poche ore dalla somministrazione.
La Nigeria prende contatti con Atlanta per il ‘siero’
Anche il governo della Nigeria, uno dei paesi in ginocchio per l’epidemia, ha chiesto agli Stati Uniti l’acquisizione dello ZMapp. “Siamo in contatto con gli statunitensi. Martedì – ha detto il ministro della Salute – ho parlato per telefono con il direttore del Centro di Prevenzione e Controllo delle malattie di Atlanta, il dottor Tom Freiden. Abbiamo parlato a lungo e scambiato sms”, ha aggiunto il ministro.
Gli specialisti inglesi agli Usa: date il siero anche all’Africa
E l’appello agli Stati Uniti arriva anche dagli specialisti di Ebola del Regno Unito. Un appello affinchè il siero “miracoloso”, usato con i due americani rimpatriati lo scorso fine settimana, “venga dato a tutti nell’Africa occidentale”. Ora i tre specialisti, Peter Piot, che scoprì il temibile virus nel 1976, David Heymann, direttore del Chatham House Centre on Global Health Security, e Jeremy Trust del Wellcome Trust dicono che “ai governi africani dovrebbe essere consentito di prendere decisioni informate sull’usare o meno questi prodotti sperimentali”, riporta l’Independent. Proprio i tre scienziati avevano chiesto all’Oms di attivarsi per fornire all’Africa occidentale le nuove medicine in fase di sperimentazione, anche considerando il propagarsi dell’epidemia. Anche da Liberia, Sierra Leone, Guinea, intanto, scrive ancora l’Independent, iniziano ad arrivare appelli alla liberalizzazione di queste sostanze.
Le polemiche attorno al siero, prodotto con la pianta del tabacco
Lo ZMapp – ricordiamo – è un siero che non era mai stato usato prima con gli esseri umani e che aveva dato risultati promettenti nei test realizzati sulle scimmie. Crescono, quindi, le polemiche attorno al vaccino sperimentale. Il farmaco, non ancora approvato dalla Food and Drug administration, l’ente americano preposto al controllo di medicine e alimenti – è prodotto con la pianta del tabacco. E sembra funzionare. Per la realizzazione del vaccino, l’azienda farmaceutica Mapp Biopharmaceutical si avvale della collaborazione di Kentucky bioprocessing, filiale del gruppo americano del tabacco Reynolds American.
La prima a diffondere il nome del farmaco è stata l’emittente televisiva americana Cnn. Il siero è prodotto da Mapp, con sede a San Diego, in California. “Si è cominciato a ipotizzare l’utilizzo del tabacco per sviluppare il vaccino perché questa pianta è in grado di produrre rapidamente anticorpi in caso di emergenza”, ha detto Charles Arntezen, esperto di biotecnologia vegetale all’Arizona state university e che in passato ha collaborato con Larry Zeitlin e Kevin Whaley, i ricercatori che sono rispettivamente presidente e amministratore delegato di Mapp. Il processo di estrazione degli anticorpi “miracolosi” è lungo e complesso. Per produrre le proteine terapeutiche dentro la pianta del tabacco, i geni per gli anticorpi desiderati sono fusi assieme ai geni di un naturale virus del tabacco, ha aggiunto Arntezen. Le piante di tabacco sono poi infettate con questo nuovo virus artificiale. “La pianta, che a questo punto produce anticorpi per contrastare l’infezione – ha concluso – viene poi macinata e gli anticorpi vengono estratti”. Un processo, questo, che richiede settimane.
Per saperne di più clicca: Marburg and Ebola Virus Infections by Craig R. Pringle, BSc, PhD
Editorial: El ébola y el interés de las farmacéuticas
Ebola: Il “fallimento morale” del settore farmaceutico
La bufala dell’ebola arrivata in Italia
La notizia era rimbalzata su Facebook lanciata da un artigiano simpatizzante di estrema destra e xenofobo. Ma l’ebola è davvero arrivata in Europa, anche se in tutta sicurezza
(foto: Leon Neal/Afp/Getty Images)
“L’ebola è arrivata in Italia, con tre casi segnalati a Lampedusa. Paura per epidemia globale”. La notizia, apparsa con tanto di foto di accompagnamento di un immigrato segnato dalle piaghe, era rimbalzata su Facebook creando il panico tra i lettori. In poche ore aveva raggiunto le 27 mila condivisioni. Ma si trattava solo di una bufala, presto smascherata dalle indagini della polizia postale.
A lanciare il falso allarme è stato un torinese di 44 anni, artigiano, simpatizzante di estrema destra e xenofobo, subito rintracciato e denunciato dalla polizia postale per la diffusione della foto e del messaggio, ormai rimossi da Facebook.
Che l’ebola sia sbarcata in Europa è però vero. Un missionario spagnolo di 75 anni sé infatti stato rimpatriato dopo aver contratto il virus in Liberia. La Spagna ha infatti inviato un aereo militare con team medico a bordo per riportare a casa il missionario Miguel Pajares.
Nel frattempo, dopo la somministrazione del siero sperimentale ai due statunitensi colpiti dal virus, anche l’Oms sta considerandol’idea di impiegare farmaci ancora in fase di studio per il trattamento della popolazione africana colpita da ebola, dove i morti sfiorano ormai il migliaio. La prossima settimana infatti l’Oms convocherà un team di esperti per valutare, dal punto di vista medico ed etico, se in via del tutto eccezionale e date le insolite circostanze, sia possibile immaginare di estendere inAfrica l’uso di trattamenti sperimentali e chi ne debba beneficiare
Agnoletto e Aiuti: “Perché il vaccino anti-Aids è fallito”
Il confronto a distanza sul vaccino anti-Aids continua. Dopo il blog con l’intervento della dottoressa Barbara Ensoli, a capo del progetto di ricerca, ecco cosa dicono Aiuti e Agnoletto, molto critici nei confronti della sperimentazione.
Pensavo che la Ensoli avesse già risposto sufficientemente alle critiche e invece no. Ecco comunque cosa dicono Aiuti e Agnoletto che ripropongono in larga parte le cose dette, in modo informale, si fs per dire, davanti alla Commissione Sanità del Senato.
(La nuova puntata della blog-story sul caso Stsmina uscirà nei prossimi giorni).
Caro Pepe,
con questo nostro intervento, intendiamo intervenire sugli aspetti scientifici del vaccino anti-Tat e commentare alcune affermazioni rilasciate dalla Dr.ssa Barbara Ensoli, principale responsabile del vaccino sperimentale in questione, al suo Blog e in altre sedi consultabili su internet. Di seguito sono riportati i punti essenziali del nostro pensiero.
1. La sperimentazione del vaccino terapeutico anti-Tat dell’ISS è iniziata nel modello sperimentale delle scimmie nel 1998 ed è giunta alla fase I (studio di non tossicità/sicurezza) nell’uomo nel 2003-5 e in fase II (immunogenicità e determinazione della dose ottimale) nel 2010, ma non ha ancora fornito risultati ritenuti di particolare interesse dalla comunità scientifica internazionale dopo svariati milioni d’investimenti (almeno 49, secondo alcune fonti; molto meno, ma comunque molti, secondo la Dr.ssa Ensoli) e 16 anni di ricerche! Infatti, non esiste in letteratura internazionale alcuna pubblicazione – ad eccezione dei modesti effetti riportati nelle pubblicazioni della Dr.ssa Ensoli e di precedenti lavori degli anni ’90 di Daniel Zagury e Alessandro Gringeri – che abbia documentato una chiara efficacia relativamente agli unici due parametri ritenuti fondamentali per il controllo dell’infezione da HIV e della sua progressione verso l’AIDS: (I) i livelli di replicazione virale misurabili nel plasma (viremia) e (II) la percentuale e/o il valore assoluto dei linfociti T CD4 circolanti. Sulla base di questi parametri dal 1987 a oggi sono stati autorizzati in tante nazioni del mondo tutti gli attuali farmaci antivirali in commercio, farmaci che finora sono gli unici ad avere definitivamente bloccato la progressione della malattia nei singoli individui e rallentato, almeno in parte, la pandemia di HIV a livello globale.
2. La sperimentazione di fase I dell’ISS, sia del vaccino terapeutico che di quello preventivo, ha sollevato critiche a livello scientifico sia nazionale che, soprattutto, internazionale anche per l’eccessiva ed ingiustificata enfatizzazione dei media. La stessa sperimentazione è stata criticata anche dall’AIFA come risulta da un documento di 4 ispettori della stessa AIFA che hanno rilevato nel corso della sperimentazione avvenuta nel periodo 2003-5 ben 7 deviazioni critiche e 3 maggiori. La rivista Science in data 10 agosto 2007 ha ripreso questo dibattito ed ha anche criticato il finanziamento diretto della sperimentazione senza che ci sia stato un bando di ricerca aperto ai vari ricercatori. Per quanto riguarda i risultati di questa sofferta fase I della sperimentazione terminata nel 2005 si è atteso fino al 2009 per la pubblicazione dei risultati (Vaccine. 2009 May 26;27:3306-12.). Ma la pubblicazione, come sottolinea il Prof. Fernando Aiuti, non riporta tra gli autori alcun medico del Policlinico Umberto I, Università Sapienza Roma che hanno pur partecipato alla sperimentazione; ovviamente, nessuno di loro ha partecipato alla stesura del lavoro.
3. Ricordiamo inoltre che l’11 giugno 2008 Maria Antonietta Coscioni, parlamentare del Pd, ha presentato un’interrogazione al ministero del Lavoro e delle Politiche Sociali e al Ministero degli Esteri (cofirmatari Matteo Mecacci, Rita Bernardini, Elisabetta Zamparutti, Marco Beltrandi, tutti del Pd, e Giuseppe Giulietti dell’Italia dei Valori, alla quale si associano Donatella Poretti e il senatore Marco Peduca) chiedendo ai ministri interrogati “se non ritengano opportuno nel rispetto del principio di trasparenza ed equità di rispondere a vari punti sul finanziamento del vaccino Tat”. Altri risultati della fase II terapeutica sono stati poi pubblicati nel 2010 su PlosOne (rivista generalista, considerata di livello differente rispetto alle riviste più importanti) dopo un’analisi ad interim ed hanno riguardato malati provenienti da 11 centri clinici italiani. A nostro avviso questo lavoro mostra alcune criticità in quanto: a) è stato condotto “in aperto” (ovvero chi somministrava il vaccino sapeva cosa stava somministrando) e non in cieco; b) perché il gruppo di controllo dei non vaccinati è stato selezionato sulla base storica degli archivi dei vari centri clinici e, infine, c) perché tutti i malati erano in terapia antivirale con viremia azzerata. Infatti, le modificazioni quantitative dei principali parametri nei vaccinati sono risultate insignificanti.
4. Sono anche trascorsi 11 anni dall’avvio della fase I nell’uomo del vaccino anti-Tat preventivo; la fase I si è conclusa nel 2005, ma nel settembre 2011 la sperimentazione è ripartita nuovamente dalla fase I, e con un differente disegno clinico che oltre alla proteina Tat comprendeva anche la proteina Env fornita dalla Novartis. Il 24 marzo 2014 – come si può verificare sul sito dell’ISS – vi è stata la sospensione dell’arruolamento per la non conformità della proteina Env di Novartis alle nuove linee guida europee in materia di requisiti di documentazione di qualità relative ai prodotti impiegati nelle sperimentazioni cliniche. Nel frattempo, la ricerca internazionale è ovviamente andata avanti producendo altri candidati vaccinali interessanti ora pervenuti alle fasi II e III. Tra questi, quelli concepiti come plasmidi contenenti DNA virale o la combinazione di almeno tre subunità proteiche del virus HIV (Gag, Env, Nef o, eventualmente, Gag, Nef, Tat + Env). Quindi, non mancano competenze e linee di ricerca perseguite dai migliori centri di ricerca internazionali. Ci chiediamo se non sarebbe opportuno sottoporre al vaglio di una commissione di esperti internazionali i risultati ottenuti dalla sperimentazione del vaccino anti-Tat dell’ISS prima di decidere se continuare la sperimentazione – con gli ovvi finanziamenti relativi – in Italia come in Sud Africa.
5. Lo sviluppo di vaccini verso altre malattie infettive non è mai stato bloccato quando i risultati si sono dimostrati robusti e sostenibili solo per il fatto che le industrie farmaceutiche avevano paura di perdere un mercato di farmaci direttamente o indirettamente collegati a queste patologie. A questo proposito la dott.ssa Ensoli dichiara “…chi me li da 100-150 milioni di € per concludere la sperimentazione?” Oggi il costo dello sviluppo di un nuovo farmaco dalla scoperta fino alla sua commercializzazione è stimato tra i 250 e 400 milioni di €, costi che le grandi industrie non hanno problemi a sostenere. Quindi, il pacchetto di brevetti dell’ISS relativi al vaccino anti-Tat potrebbe essere venduto o concesso in licenza d’uso all’industria specializzata con profitto per l’istituto pubblico (nonché per gl’inventori dei brevetti). Ovviamente, il partner industriale deve “credere” nella bontà potenziale del farmaco (un vaccino terapeutico può essere considerato tale) o del vaccino preventivo in oggetto per investirci, evento che, ad oggi, non si è verificato per il vaccino anti-Tat dell’ISS.
6. Su questo tema vale anche la pena di ricordare la vicenda che ha suscitato un recente dibattito nazionale. Nel mese di marzo c.a. che il Consiglio di Amministrazione dell’ISS (delibera n. 7 del 2014) ha concesso la licenza del vaccino TAT per 18 mesi ad una Società privata, la Vaxxit Srl con capitale sociale di 10.000 € e con il 70% delle quote di proprietà detenute dalla stessa Dr.ssa Ensoli, per il 30% a un ex consulente dell’ISS (Dr. Giovanni Battista Cozzone, esperto brevettuale). Dopo le critiche pubbliche, sollevate in particolare dal mensile Altreconomia pervenute all’operazione e l’interrogazione parlamentare della Sen. Emilia De Blasi, Presidente della Commissione Sanità del Senato, a giugno il Consiglio di Amministrazione dell’ISS ha fatto un passo indietro ritirando (almeno temporaneamente) la delibera di concessione alla Vaxxit Srl. Nel frattempo l’ISS, per la prima volta nella sua storia, è stato commissariato e la delibera è ora in mano al nuovo commissario dell’ISS. Nel frattempo, nella Vaxxit Srl – che risulta aver iniziato a cercare capitali sul mercato – sono entrati nuovi soci, tra i quali il fratello della Dr.ssa Ensoli, il Dr. Fabrizio Ensoli del San Gallicano (altra istituzione recentemente commissariata), il suo ex-marito, il Dr. Aurelio Cafaro, ricercatore all’ISS, il più grande fondo Canadese (Teralys Capital) ed una multinazionale del credito (Ferghana Securities Inc.) con domicilio nel Delaware, USA, stato americano a fiscalità agevolata, oltre ad un rappresentante di un’ONG italiana che da tempo si è distinta per essersi schierata in pubblica difesa del vaccino anti-Tat dell’ISS.
Vede, caro Pepe, se lo studio vaccinale della Dr.ssa Ensoli fosse a suo tempo rientrato nell’alveo del Progetto AIDS, i cui finanziamenti erano frutto di una sana competizione tra i progetti migliori grazie al meccanismo della “peer review”, non avrebbe avuto probabilmente nulla di scandaloso. Invece questo progetto è stato finanziato per decine di milioni di euro direttamente per decisioni governative senza consultazioni preventive con esperti nazionali ed internazionali indipendenti. Si aggiunga che nel corso degli anni i risultati sono stati al più modesti, senza alcuna efficacia rilevante sulla viremia e valori dei linfociti Cd4 troppo dilazionati nel tempo e con incerte prospettive di sviluppo, come dimostrato dal fatto che le principali farmaceutiche specializzate nella messa a punto di vaccini non si sono fatte avanti per rilevare o avere in concessione d’uso i brevetti dell’ISS.
Ci auguriamo che la recente audizione al Senato (di cui sopra) presso la Commissione Igiene Sanità di alcuni esperti coinvolti in questa vicenda possa portare utili suggerimenti all’attuale Governo, al neo commissario dell’ISS ed ai Ministri della Salute e degli Affari Esteri.
Noi firmatari di questo documento abbiamo diverse opinioni politiche, ma in questo caso condividiamo l’idea che la ricerca di qualità e la promozione della prevenzione debbano essere finanziate in Italia attraverso un sistema di valutazione che coinvolga esperti sia nazionali che internazionali per formulare una scelta oculata dei temi più attuali ed importanti mediante un bando competitivo e trasparente senza condizionamenti o scavalcamenti dalla politica o corsie preferenziali come si è verificato nel caso del candidato vaccinale dell’ISS basato sulla proteina virale Tat. Il problema è urgente perché l’epidemia da HIV ogni anno in Italia continua a infettare circa 4000 persone e il 50% circa degli individui scoprono di essersi infettati solo quando sono già nella fase di AIDS conclamata. Rinunciare alla ricerca pubblica e libera da condizionamenti del mondo politico e dell’industria farmaceutica significa rinunciare ad un po’ di libertà ed abdicare dallo status di un paese civile ed avanzato quale l’Italia ambisce ancora di essere.
Cordialmente,
Prof. Vittorio Agnoletto
Università Statale, Milano
Prof. Fernando Aiuti
Professore Emerito Università “Sapienza” Roma
(le opinioni qui espresse sono a titolo personale e non intendono rappresentare in alcun modo l’opinione delle istituzioni presso cui i firmatari lavorano o hanno lavorato negli scorsi anni)
guglielpepe@gmail.com
@pepe_guglielmo (Twitter)






