
Verso un’Europa più competitiva e innovativa nel settore dei dispositivi medici e diagnostici
Ministero della Salute – 17 dicembre 2025
La Commissione Europea ha pubblicato una proposta di revisione mirata dei regolamenti (UE) 2017/745 e 2017/746, che disciplinano il sistema dei dispositivi medici e dei dispositivi medico-diagnostici in vitro, per  semplificare le regole, garantire la sicurezza dei pazienti e sostenere l’innovazione nel settore dei dispositivi medici e diagnostici in vitro.
semplificare le regole, garantire la sicurezza dei pazienti e sostenere l’innovazione nel settore dei dispositivi medici e diagnostici in vitro.
Perché questa revisione è importante
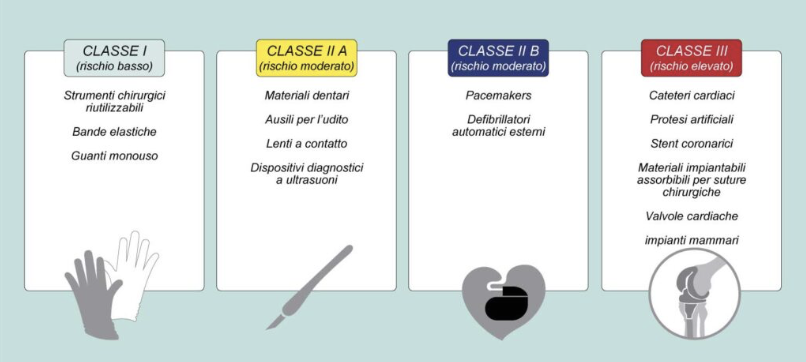
I dispositivi medici – dai cerotti ai pacemaker, dai software diagnostici agli impianti complessi – salvano vite e migliorano la cura dei pazienti.
L’industria europea conta oltre 930.000 persone impiegate in 38.000 aziende, di cui il 90% piccole e medie imprese (PMI). Tuttavia, l’attuale normativa presenta complessità e procedure divergenti che rallentano innovazione, competitività e accesso ai dispositivi.
Cosa cambia con la semplificazione
 Riduzione del carico amministrativo e procedure più snelle per tutte le aziende, con particolare attenzione alle PMI.
Riduzione del carico amministrativo e procedure più snelle per tutte le aziende, con particolare attenzione alle PMI.- Requisiti più proporzionati e prevedibili per dispositivi a basso e medio rischio e per pazienti con esigenze speciali (bambini, malattie rare).
- Supporto all’innovazione tramite percorsi regolatori flessibili e “regulatory sandbox” per testare nuove tecnologie in sicurezza.
- Maggiore digitalizzazione di istruzioni, etichettature e procedure di conformità.
- Rafforzamento della coordinazione a livello UE e collaborazione con EMA per garantire coerenza scientifica e regolatoria.
- Miglioramento della trasparenza e tracciabilità con EUDAMED e prevenzione delle carenze di dispositivi critici.
Benefici principali
 Pazienti e operatori sanitari avranno accesso più rapido a dispositivi sicuri e innovativi.
Pazienti e operatori sanitari avranno accesso più rapido a dispositivi sicuri e innovativi.
Le PMI troveranno procedure più chiare e prevedibili, riducendo le barriere all’ingresso.
Il settore diventa più competitivo e attrattivo per investimenti, stimando 3-5 miliardi di euro di risparmi annui grazie a processi più efficienti.
Questa revisione non è solo una semplificazione: è un passo strategico per rafforzare l’Europa come hub globale per dispositivi medici sicuri, innovativi e accessibili.
Notizie correlate: Elenco dei Dispositivi
Payback dispositivi medici, Conflavoro Pmi Sanità: ora servono atti concreti per le Pmi





