
Ho scritto più di una volta dalle pagine di questo spazio il mio dubbio sull’equivalenza assoluta terapeutica fra farmaco e generico.
di Domenico De Felice | 20 maggio 2015 | Il Fatto Quotidiano
 Molto si è parlato inutilmente in queste settimane di prevenzione e diagnosi precoce per i tumori della mammella fra la Lorenzin, Grillo e Renzi con un intercalare più da campagna elettorale che interesse vero per il cittadino paziente.
Molto si è parlato inutilmente in queste settimane di prevenzione e diagnosi precoce per i tumori della mammella fra la Lorenzin, Grillo e Renzi con un intercalare più da campagna elettorale che interesse vero per il cittadino paziente.
Prevenire vuol dire non far venire una malattia mentre diagnosi precoce vuol dire scoprire una malattia prima che sia tardi ma la malattia è comunque già insorta ed ha provocato i suoi segni e sintomi. Naturalmente è meglio una diagnosi precoce ad una tardiva ma la medicina dovrebbe lavorare per prevenire. Vincerebbe. In questa ottica l’utilizzo di farmaci che prevengono il complicarsi delle patologie dovrebbero essere presi in considerazione.
In oculistica esiste una patologia che è la seconda causa al mondo di cecità, dopo il diabete, il glaucoma. Basterebbe uno screening di massa per prevenire una patologia che ha in Italia una incidenza di circa il 10% con grave ricaduta sociale ed economica, basterebbe, come dico da anni, rendere la misurazione della pressione oculare obbligatoria durante il rinnovo della licenza di guida che si fa sempre più frequentemente con il passare degli anni proprio come l’incidenza del glaucoma.
 Naturalmente la diagnosi sarà seguita da una terapia, che oggi ha ridotto notevolmente la necessità di giungere all’intervento chirurgico. Ma questa terapia sarà sicura anche con colliri generici o avremo comunque un progredire del fenomeno con grave compromissione del campo visivo?
Naturalmente la diagnosi sarà seguita da una terapia, che oggi ha ridotto notevolmente la necessità di giungere all’intervento chirurgico. Ma questa terapia sarà sicura anche con colliri generici o avremo comunque un progredire del fenomeno con grave compromissione del campo visivo?
A gennaio 2015 è stata pubblicata in Europa la quarta edizione delle Linee Guida per il glaucoma alle pagine 153-158 la Società Europea del Glaucoma scrive:
– La bioequivalenza tra trattamenti generici e a marchio non può essere stabilita nelle gocce oculari per uso topico. E’ ritenuta accettabile una differenza del 10% di concentrazione del principio attivo tra farmaci generici e a marchio e inoltre, per l’approvazione, non sono necessari studi clinici.
– Gli eccipienti possono variare notevolmente tra i farmaci a marchio e quelli generici, il che può alterare viscosità, osmolarità e pH delle gocce oculari con un evidente impatto su tollerabilità e penetrazione oculare.
– Gli studi hanno anche mostrato differenze nelle dimensioni e nella quantità delle gocce, nella struttura e nei tappi dei flaconcini.
– Poiché le gocce oculari generiche possono essere diverse da quelle a marchio, può essere necessario monitorare maggiormente i pazienti se si cambia prodotto.
 Aspetto da anni che gli organi competenti, a cominciare dalla signora Lorenzin, dal Consiglio Superiore della Sanità da lei eletto e da Luca Pani, da lei nominato che tanto si impegna per la promozione dei farmaci generici, diano una risposta a queste affermazioni.
Aspetto da anni che gli organi competenti, a cominciare dalla signora Lorenzin, dal Consiglio Superiore della Sanità da lei eletto e da Luca Pani, da lei nominato che tanto si impegna per la promozione dei farmaci generici, diano una risposta a queste affermazioni.
E se annullassimo questa dualità non certo utile al cittadino-paziente producendo solo farmaci “specifici”?
Domenico De Felice, Medico, opinionista di sanità sociale
N.d.R.: Nessuno ha da dire sui farmaci equivalenti o generici in sé. Però è indubbio che ci sono delle forti perplessità su cui 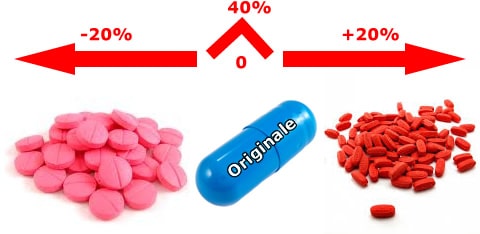 bisognerebbe fare chiarezza:– Due formulazioni sono definite bioequivalenti se si può determinare che la differenza tra le loro biodisponibilità rientri in un intervallo predefinito come “intervallo accettabile” di bioequivalenza, fissato nell’intervallo 0,80-1,25 convenzionalmente ritenuto compatibile con l’equivalenza terapeutica, con un margine di tolleranza quindi del ± 20% con il farmaco originale. Non esistendo in Italia, a differenza di altri paesi (si veda L’Orange Book negli USA), la comparazione fra generici ciò significa che fra due generici potrebbe sussistere una differenza anche del 40% e vista la facilità con cui i farmacisti cambiano un generico con un altro … . Manca poi la definizione dei singoli farmaci e/o delle classi di farmaci a ristretto indice terapeutico (quelli per cui una minima differenza può comportare sensibili variazioni di efficacia e sicurezza).
bisognerebbe fare chiarezza:– Due formulazioni sono definite bioequivalenti se si può determinare che la differenza tra le loro biodisponibilità rientri in un intervallo predefinito come “intervallo accettabile” di bioequivalenza, fissato nell’intervallo 0,80-1,25 convenzionalmente ritenuto compatibile con l’equivalenza terapeutica, con un margine di tolleranza quindi del ± 20% con il farmaco originale. Non esistendo in Italia, a differenza di altri paesi (si veda L’Orange Book negli USA), la comparazione fra generici ciò significa che fra due generici potrebbe sussistere una differenza anche del 40% e vista la facilità con cui i farmacisti cambiano un generico con un altro … . Manca poi la definizione dei singoli farmaci e/o delle classi di farmaci a ristretto indice terapeutico (quelli per cui una minima differenza può comportare sensibili variazioni di efficacia e sicurezza).
– Non esistono studi per dimostrare l’equivalenza terapeutica, di efficacia e sicurezza (si suppone soltanto che ci sia, a parità di molecola).
– Non esiste un controllo preventivo da parte delle Autorità Regolatorie. Ė sufficiente un’autocertificazione del titolare dell’A.I.C. o del paese produttore del principio attivo o degli eccipienti per l’immissione in commercio. L’autorità regolatoria agirà su segnalazioni o a campione. Dati presenti nella letteratura medico-scientifica internazionale, alcune esperienze condotte in Italia e le segnalazioni di reazioni avverse ai farmaci presenti nel database dell’AIFA (compresi i casi di inefficacia terapeutica) concorrono a sostenere l’ipotesi che nei mercati farmaceutici di vari Paesi (compresa l’Italia) accanto a farmaci equivalenti di buona qualità siano presenti anche farmaci equivalenti di scarsa qualità. Senza norme in tal senso il “cattivo” generico scredita tutta la categoria dei generici.
– Gli eccipienti possono variare ed incidono in modo fondamentale sulla biodisponibilità, soprattutto in alcuni preparati, come per esempio le gocce oculari, le soluzioni, ecc..
 Se un farmaco generico provoca danni, di chi è la responsabilità? Del medico che prescrive? Del farmacista che sostituisce? Del sistema regolatorio che impone? Le politiche di favore verso i farmaci generici rischiano in molti casi di deresponsabilizzare gli operatori sanitari, con rischi legati alla sicurezza delle terapie e alla salute dei cittadini.
Se un farmaco generico provoca danni, di chi è la responsabilità? Del medico che prescrive? Del farmacista che sostituisce? Del sistema regolatorio che impone? Le politiche di favore verso i farmaci generici rischiano in molti casi di deresponsabilizzare gli operatori sanitari, con rischi legati alla sicurezza delle terapie e alla salute dei cittadini.
– Il prezzo di riferimento. Con la scadenza del brevetto di un farmaco di marca possono essere commercializzati i relativi generici con prezzi più bassi. Anche il produttore del farmaco di marca abbassa notevolmente il prezzo del farmaco alla scadenza del brevetto, ma non può, per legge, essere uguale o inferiore al prezzo dei generici, il più basso dei quali diventa il prezzo di riferimento per tutti quei farmaci contenenti quello stesso principio attivo. La differenza fra prezzo di riferimento e farmaco di marca è a carico del cittadino, comunque è abbastanza modesta. In sostanza, il rimborso del SSN è già fissato al prezzo più basso tra quelli dei farmaci equivalenti in commercio e la spesa pubblica relativa resta quindi sganciata dal tipo di prescrizione effettuata, per cui il risparmio dello Stato dov’è?
– Uno dei più incompetenti ministri della Salute diceva che la prescrizione del solo principio attivo serve a scardinare il rapporto stretto tra medici e case farmaceutiche, la norma attuale però al più sposta soltanto il momento della scelta del farmaco dal medico al farmacista. E chi ci dice che il farmacista non abbia più interesse a vendere un determinato generico piuttosto che un altro? Perché poi il farmacista può comprare, per legge, i generici con uno sconto maggiore rispetto ai farmaci di marca?
– L’effetto che, piuttosto, si profila all’orizzonte dell’applicazione della norma è di redistribuire le quote del mercato dei farmaci a favore degli equivalenti, di spostare il consumo verso questi senza che vi sia un risparmio per le casse pubbliche, ma orientando piuttosto le scelte dei pazienti. È chiaro che un obiettivo del genere nulla ha a che vedere con il contenimento della spesa.
– Molti Servizi Sanitari Regionali incentivano l’uso dei generici non solo con campagne di stampa, ma istituendo premi in denaro o punizioni se i medici di medicina generale non prescrivono generici. Una sorta di orrendo comparaggio. Ma a chi giova, stante un prezzo di riferimento? Si ricorda, per inciso, che l’82% del mercato dei generici è costituito da 5 aziende (Teva, Mylan, Sandoz, Doc generici, EG).
Notizia correlata: Generici equivalenti o di marca? Il parere degli esperti (veri)
Generici, Snami: continua sostituzione “selvaggia” in farmacia e in ospedale
I concetti di equivalenza farmaceutica e equivalenza terapeutica
La prescrizione del farmaco generico e il biocreep
Gli effetti collaterali delle nuova disciplina delle prescrizioni (Ist. Bruno Leoni pdf)
Farmaci Equivalenti (SIF Società Italiana di Farmacologia, Position paper)
Rapporto Osmed dell’Agenzia italiana del farmaco (Aifa)
EMA conferma sospensione commercializzazione farmaci sperimentati in CRO indiana
Responsabilità civile del medico e definizione di atto medico
Qualità farmaci equivalenti, Congresso Usa chiede un rapporto su ispezioni Fda
Gli sconti, gli extra-sconti e i margini di guadagno della farmacia
Quant’è il margine di un farmacista sui farmaci che vende?
Per rispondere bisogna fare riferimento all’art. 13 (Spesa farmaceutica ed altre misure in materia di spesa sanitaria) del Decreto-legge 28 aprile 2009, n. 39 convertito nella legge 24 giugno 2009, n. 77
Inoltre si può consultare su Federfarma “Margini e sconti”, molto interessante anche “Gli extra sconti sui farmaci “A”: un problema risolto?”
Si deve anche consultare il Decreto Ministro della Salute, di concerto con il Ministro dell’Economia e delle Finanze, previa intesa presso la Conferenza-Stato Regioni. Tale Decreto si basa sull’accordo stipulato tra Aifa e associazioni di categoria (stipulato ad Ottobre 2012).
Pertanto in teoria i margini sul prezzo (su prodotti rimborsati) sono fissi e le imprese / grossisti non possono fare sconti (fuori legge) a valle (farmacie), tuttavia le imprese hanno praticato sconti alla distribuzione che si sono riflessi in vantaggi economici per la distribuzione stessa (finale, cioè la farmacia). Gli sconti intra-filiera produttore, grossista, farmacia) sono sanzionati (per la farmacia la sanzione, in caso di violazione, varia da 500 a 3000 euro e, in caso di reiterazione, può essere disposta la chiusura della farmacia per non meno di 15 giorni).
Secondo le norme, in caso di acquisto di farmaci equivalenti dall’industria lo sconto massimo ottenibile per legge dalla farmacia è pari a (30,35% + 3% + 8% =) 41,35%. Questo limite viene eluso con una certa frequenza stipulando con il fornitore accordi commerciali con i quali il farmacista si impegna a “promuovere” il prodotto.
Si segnala sul nostro sito:
Istituzione del generico: Legge 28 dicembre 1995, n. 549
Farmaci ‘specifici’ o generici: perché non c’è chiarezza? Il caso della medicina oculistica. N.d.R





