Stretti tra medici, farmacisti, informatori scientifici (quelli che saltano la fila in ambulatorio…) e case farmaceutiche, cosa dobbiamo sapere per scegliere con consapevolezza come curarci? Sono convenienti e quasi sempre uguali a quelle con il brevetto, eppure da noi se ne consumano meno che negli altri Paesi
di Cinzia Lucchelli – 06 febbraio 2015 – GAZZETTA DI MANTOVA
“Farmaco non sostituibile, medico incredulo sulle virtù dei generici”. Si legge anche questo sui timbri dei medici che difendono i medicinali di marca dai loro equivalenti. Oltre ai dubbi sull’ortodossia della forma, la foto di una ricetta con questa scritta, postata su Facebook, ha provocato un vespaio di reazioni. Antidolorifici, antibiotici, anticolesterolo generici sono efficaci tanto quanto gli originali? Il dibattito è aperto. In Italia il consumo è in costante aumento ma stenta ad affermarsi. «Oggi su 100 confezioni vendute, 20 sono di generici – dice Enrique Häusermann, presidente di AssoGenerici – per quanto riguarda la spesa, su 100 euro il 10% è dovuto ai generici». Ma siamo indietro rispetto all’Europa.
Questo nonostante gli equivalenti costino almeno il 20% in meno e nonostante i medicinali disponibili in Italia siano gli stessi prescritti in Europa (sono prodotti da multinazionali). Da dove nascono allora ritardo e diffidenza? E soprattutto, stretti tra medici, farmacisti, informatori scientifici (quelli che saltano la fila in ambulatorio…) e case farmaceutiche, cosa dobbiamo sapere per scegliere con consapevolezza come curarci?
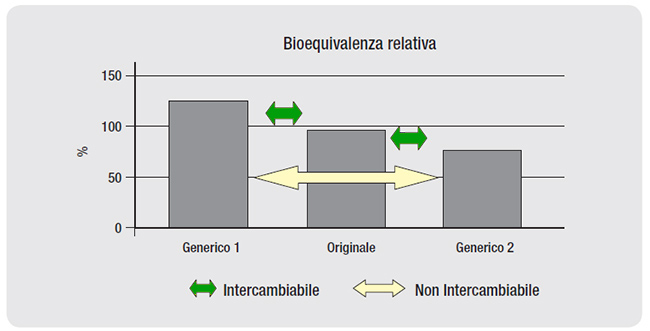 Stessa formula. Un farmaco generico è la copia di un farmaco di marca presente sul mercato da anni e non più coperto da brevetto. Contiene lo stesso principio attivo, nella stessa quantità. Ne condivide forma farmaceutica, via di somministrazione (ad esempio compresse), dosaggio. Inoltre è un bioequivalente del medicinale di riferimento, vale a dire, come scrive l’Agenzia italiana del farmaco, con la stessa dose i profili di concentrazione nel sangue dei due medicinali rispetto al tempo «sono così simili che è improbabile che possano produrre differenze rilevanti negli effetti di efficacia e sicurezza».
Stessa formula. Un farmaco generico è la copia di un farmaco di marca presente sul mercato da anni e non più coperto da brevetto. Contiene lo stesso principio attivo, nella stessa quantità. Ne condivide forma farmaceutica, via di somministrazione (ad esempio compresse), dosaggio. Inoltre è un bioequivalente del medicinale di riferimento, vale a dire, come scrive l’Agenzia italiana del farmaco, con la stessa dose i profili di concentrazione nel sangue dei due medicinali rispetto al tempo «sono così simili che è improbabile che possano produrre differenze rilevanti negli effetti di efficacia e sicurezza».
Prezzi diversi. Formule uguali dunque, ma prezzi diversi. Questo perché quando un’azienda mette a punto un farmaco lo protegge, nell’Unione europea, con un brevetto di 20 anni. Periodo durante il quale può vendere il medicinale a un prezzo che le permetta di recuperare l’investimento per ricerca e studi necessari a dimostrarne efficacia e sicurezza. Le aziende che a copertura scaduta copiano e producono il farmaco come generico possono abbassare il prezzo perché non devono più investire in ricerca e studi.
Il mercato in Italia. Nel 2012, si legge nel Rapporto nazionale Osmed, gli equivalenti hanno rappresentato il 13,4% del totale della spesa (erano il 9,5% nel 2011). A più ampio raggio, il consumo di farmaci a brevetto scaduto rappresenta il 62% dei consumi in regime di assistenza convenzionata; il 37,7% della spesa netta convenzionata. Aumenta il consumo, eppure, non decolla. Soprattutto in confronto a Inghilterra, Francia e Germania.
Generici solo nel nome, La diffidenza forse nasce già dal nome. «La gente li conosce come “generici”, un termine che suona male – dice Silvio Garattini, direttore dell’Istituto Mario Negri di Milano – ma quello che è generico non è il farmaco, bensì il suo nome». Nome, infatti, che non è né chimico né di fantasia. Dal 2005 i generici in Italia vengono chiamati equivalenti.
 Il dubbio degli eccipienti. Altro motivo di cautela riguarda gli eccipienti, le uniche sostanze che cambiano tra farmaco di marca e generico. Non hanno attività farmacologica, servono a rendere somministrabile il principio attivo. Ma possono avere rilevanza per la sicurezza del medicinale: i farmaci con saccarosio devono essere somministrati con attenzione ai diabetici, quelli con lattosio non vanno bene per chi è intollerante. Un medico che conosce il paziente sa come comportarsi.
Il dubbio degli eccipienti. Altro motivo di cautela riguarda gli eccipienti, le uniche sostanze che cambiano tra farmaco di marca e generico. Non hanno attività farmacologica, servono a rendere somministrabile il principio attivo. Ma possono avere rilevanza per la sicurezza del medicinale: i farmaci con saccarosio devono essere somministrati con attenzione ai diabetici, quelli con lattosio non vanno bene per chi è intollerante. Un medico che conosce il paziente sa come comportarsi.
Ritardo causa brevetto. I tempi lunghi dei brevetti, poi, sono tra le cause del ritardo dei generici in Italia. Nel 1991 è stato introdotto un Certificato complementare di protezione che prolungava fino a 38 anni l’esclusività dello sfruttamento di una molecola. Misura superata l’anno dopo da un regolamento Cee che concedeva l’estensione del brevetto di massimo cinque anni. Ma intanto l’80% dei principi attivi sul mercato aveva ottenuto una copertura più lunga. Facendo slittare l’ingresso dei generici e i conseguenti risparmi per il Sistema sanitario nazionale.
Quando decide il medico. Griffato o generico? In alcuni casi sceglie il medico. Quando ha in cura per la prima volta un paziente sulla ricetta può indicare solo il principio attivo e il farmacista dovrà fornire il generico dal costo più basso (lo Stato, tra confezioni equivalenti, rimborsa quella più economica e se il paziente chiede un prodotto di marca paga la differenza). Ma il medico può anche indicare il nome commerciale del farmaco. Se poi aggiunge “non sostituibile” il farmacista può fornire solo il farmaco “griffato”.
_______________________________________________________________
N.d.R.: definire gli Informatori Scientifici del Farmaco: “quelli che saltano la fila in ambulatorio…” implica un implicito giudizio, anzi un pregiudizio. Ma non vogliamo entrare in una polemica con chi ha pre-giudizi. Né vogliamo entrare nel merito dei vari capitoli “pro generici” enunciati perché richiederebbe troppo spazio.
Visto però che vengono citati i Dati Osmed 2012 (evidentemente fanno comodo al Dr. Häusermann), informiamo che è on line il Rapporto OsMed 2014 e testualmente dice: “I farmaci a brevetto scaduto rappresentano oramai oltre la metà (51,1%) della spesa farmaceutica convenzionata, in crescita rispetto al 2013 del +6,6%, e il 70,4% delle DDD totali, in crescita rispetto al 2013 del +11,9%. La percentuale dispesa per i farmaci equivalenti (farmaci a base di principi attivi con brevetto scaduto, ad esclusione di quelli che hanno goduto di una copertura brevettuale) è stata pari al 28,8% del totale dei farmaci a brevetto scaduto (Tabella 12). Complessivamente, i primi venti principi attivi a brevetto scaduto rappresentano circa il 50% dei consumi, in termini di DDD, di tutti i farmaci a brevetto scaduto; il pantoprazolo e il lansoprazolo,sceso in seconda posizione nel 2014,sono risultati i principi attivi a brevetto scaduto a maggior spesa, con rispettivamente 217,5 e 189,2 milioni di euro”.
Inoltre AIFA afferma: Per le sostanze attive importate da paesi che non appartengono alla UE che “potranno entrare in Italia per essere utilizzate nella produzione di medicinali per uso umano” sottolinea Isabella Marta, Unità Dirigenziale Ispezioni Materie Prime dell’AIFA, “solo se accompagnate da una certificazione dell’Autorità competente del Paese di produzione, che ne attesti l’equivalenza allo standard di qualità valido in Europa, o se accompagnate da un certificato GMP di un Paese europeo. Tale misura è a tutela della qualità dei medicinali prodotti e commercializzati in Italia. L’AIFA, inoltre, potrà ispezionare produttori o importatori di eccipienti, in caso di sospetta non conformità ai requisiti di qualità attesi ed, eventualmente, se ritenuto opportuno nell’ambito della collaborazione con il Ministero della Salute, distributori di sostanze attive situati in territorio nazionale o stabiliti in paesi terzi” ( Guida all’implementazione del Decreto Legislativo n. 17 del 19 Febbraio 2014, per ciò che concerne le sostanze attive e gli eccipienti )
Ė da notare che l’FDA ha costituito una task force appositamente incaricata di verificare in loco la qualità del principio attivo e il metodo di produzione poiché non si fida assolutamente della certificazione dell’Autorità competente del Paese di produzione e pubblica “Orange Book” in cui certifica la reale equivalenza fra generici e farmaci di marca.
Ognuno ne tragga le conclusioni che vuole.
Per amore della verità.
Notizia correlata: Farmaci generici, Osmed: iniziano a convincere gli italiani