
Nei giorni scorsi avevamo pubblicato la notizia dell’istituzione del Regolamento sulle Modalità di Accesso Degli Informatori Scientifici del Farmaco” nelle strutture dell’ASP di Messina.
Riportiamo ora il documento integrale: ASP Messina Regolamento acccesso ISF e la delibera-1855-DG-23-07-2019-1.pdf
Sotto ne pubblichiamo un estratto
Gli ISF dovranno essere dotati di tesserino identificativo.
Le Aziende interessate a svolgere attività di informazione medico scientifica nella Regione Siciliana devono comunicare al Servizio 7 “Farmaceutica” – Dipartimento per la PianificazioneStrategica dell’Assessorato della Salute, in merito ai professionisti sopra indicati, quanto previstodal D.D.G. n.2528/2013.
Spazi dedicati
L’attività degli IS/ISF, all’interno delle strutture dell’ASP di Messina, deve essere assicurato ed agevolato dalle direzioni sanitarie (Dipartimenti, Distretti, Presidi Ospedalieri), attraversol’individuazione di locali idonei (sala medici, biblioteca di reparto, studio del medico), in fasce orarieconcordate con il Responsabile della U.O..
 Tali modalità dovranno essere visibilmente pubblicizzate all’ingresso della struttura.
Tali modalità dovranno essere visibilmente pubblicizzate all’ingresso della struttura.
Modalità d’accesso
Per l’accesso alle strutture dell’ASP di Messina, gli IS/ISF e/o gli operatori delle aziende produttrici/distributrici di DM devono esibire il proprio tesserino di riconoscimento regionale, congiuntamente al quale può essere richiesto un documento di riconoscimento personale in corso di validità, pena non poter essere ricevuti dal personale interessato.
Le modalità di accesso per il ricevimento sono comunicate attraverso appositi avvisi (allegati 1, 2, 3), da posizionarsi in prossimità dei locali individuati per questa attività, nonché all’ingresso delle singole UU.OO. e in ogni altro locale ritenuto utile ad assicurarne la massima visibilità ancheall’utenza.
Per quanto riguarda i farmacisti che lavorano presso i punti di Distribuzione Diretta, il ricevimento deve avvenire al di fuori degli orari di apertura al pubblico, previo appuntamento.
Programmazione incontri
Gli incontri tra i professionisti dell’Azienda con gli IS/ISF e tutti gli altri operatori delle Aziende farmaceutiche e delle Aziende produttrici/fornitrici di dispositivi medici (DM) e diagnostici in vitro (IVD) sono svolti per appuntamento secondo le modalità previste dai Direttori delle UU.OO..
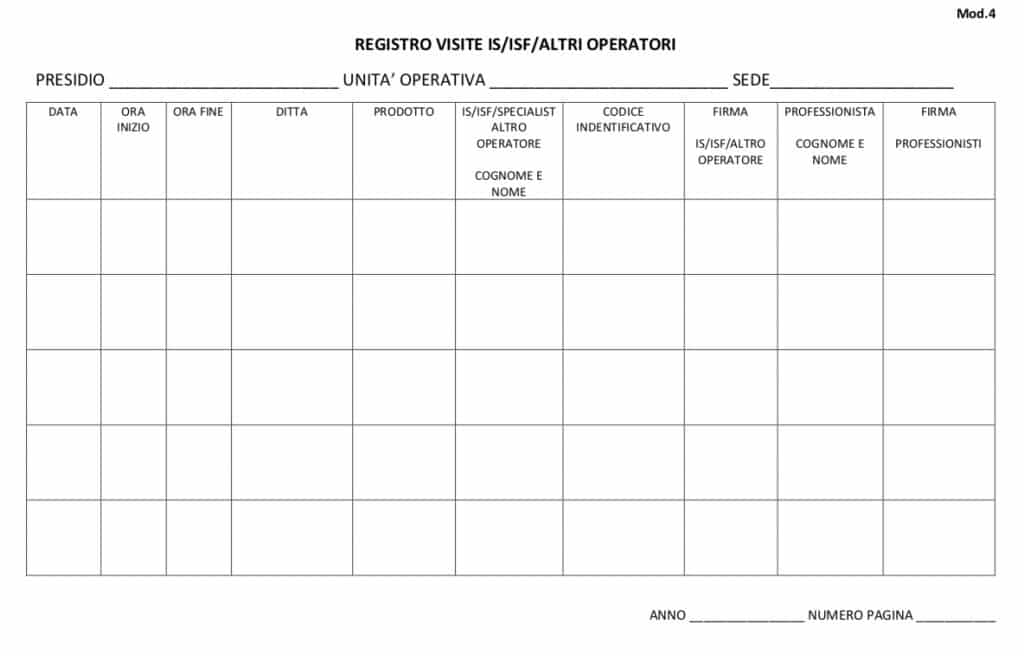 Il Direttore dell’U.O., pertanto, deve predisporre un “Registro delle presenze” (allegati 4, 5), vidimato dallo stesso, tenuto presso la struttura interessata, riportante per ogni riga la data, la Dittae il nome dell’IS/ISF/altro operatore, l’ora di ingresso, l’ora di uscita dell’IS/ISF/altro operatore, il nome del prodotto presentato, il nominativo del medico ricevente.
Il Direttore dell’U.O., pertanto, deve predisporre un “Registro delle presenze” (allegati 4, 5), vidimato dallo stesso, tenuto presso la struttura interessata, riportante per ogni riga la data, la Dittae il nome dell’IS/ISF/altro operatore, l’ora di ingresso, l’ora di uscita dell’IS/ISF/altro operatore, il nome del prodotto presentato, il nominativo del medico ricevente.
La tracciabilità degli accessi consente, inoltre, la facilitazione dei controlli in loco, volti ad accertare il rispetto delle fasce orarie previste.
Tutti gli IS/ISF e gli altri operatori delle Aziende farmaceutiche e delle Aziende produttrici/fornitrici di dispositivi medici (DM) e diagnostici in vitro (IVD) dovranno essere informati circa l’obbligo di annotazione degli accessi nel predetto registro.
Nell’ambito della programmazione degli incontri, si auspica vengano privilegiati incontri collegiali organizzati all’interno della U.O./Dipartimento interessati. Agli incontri possono partecipare le Direzioni di Dipartimento e di Distretto ed eventualmente il Direttore del Dipartimento Farmaceutico e l’Ingegnere Clinico o loro delegati.
Limiti dell’attività degli ISF
Il numero delle visite individuali di ogni ISF/operatore delle Aziende farmaceutiche e delle Aziende produttrici/fornitrici di dispositivi medici (DM) e diagnostici in vitro (IVD) ai singoli medici dipendenti, è quantificabile indicativamente in un massimo di 5 per anno, per ogni medico interessato alla prescrizione.
A questo limite è possibile derogare nel caso in cui l’Azienda Farmaceutica oproduttrice/distributrice di DM/IVD abbia necessità di comunicare al medico/professionista nuove e rilevanti informazioni circa l’uso appropriato del proprio prodotto (nuove indicazioni terapeutiche,eventi avversi, etc…), con particolare riferimento a modifiche del Riassunto delle Caratteristiche del Prodotto (RCP), che prevedano nuove indicazioni terapeutiche e/o nuove istruzioni d’uso e/o informazioni sulla sicurezza e sulla farmaco o dispositivo-vigilanza.
Gli IS/ISF non possono svolgere alcuna attività di tipo commerciale presso la farmacia ospedaliera o i punti di distribuzione diretta.
Gli IS/ISF, inoltre, non possono chiedere al farmacista informazioni sulle abitudini prescrittive dei medici.
Gli IS/ISF devono svolgere individualmente la loro attività presso i medici/professionisti: lapresenza di capoarea o altre figure professionali non correlate all’attività di informazione scientifica, è ammessa solo per funzioni diverse dall’informazione (ad esempio, tutoraggio professionale,organizzazione e proposizione di eventi formativi, progetti di ricerca, etc…).
Al fine di evitare la dispersione di risorse nel caso di attività di informazione sui singoli, sono preferibili gli incontri multidisciplinari, che coinvolgono più professionisti aziendali, al fine di approfondire alcuni aspetti o per la presentazione di nuovi aspetti.
Le ditte che sono interessate ad organizzare incontri multidisciplinari devono presentare richiesta alla U.O. Formazione e Aggiornamento e, per conoscenza, alla Direzione Generale, a mezzodell’apposito modulo aziendale (allegato 6), specificandone oggetto e finalità, da sottoporre alla competente valutazione della stessa che può avvalersi del parere della U.O.C. Assistenza Farmaceutica Ospedaliera / Farmacia ospedaliera.
Nel caso in cui a tali incontri debbano essere presenti soggetti diversi dai professionisti aziendali e dagli IS/ISF debitamente dichiarati secondo il presente regolamento, la partecipazione deve essere soggetta ad autorizzazione da parte della U.O. Formazione e Aggiornamento, dopo presentazione dei dati identificativi e professionali relativi a tali soggetti, che ne giustificanol’interesse.
Il Dipartimento del Farmaco assicura la partecipazione di un farmacista agli incontri multidisciplinari organizzati in Azienda, al fine di garantire il valore scientifico e l’assenza di qualsiasiforma, anche indiretta, di conflitto di interessi.
Controllo e monitoraggio
L’attività di vigilanza e controllo prevista dal presente regolamento è garantita da:
- i Direttori delle UU.OO. coinvolte che garantiscono l’applicazione ed il rispetto del presenteregolamento, i quali processano le segnalazioni pervenute dai professionisti coinvolti, in particolare quelle concernenti i requisiti di accesso degli Specialist alle sale operatorie ed alle aree sanitarie similari;
- la Direzione di Presidio / Distretto Sanitario / Dipartimento che svolge l’attività di vigilanza e controllo per la parte relativa agli aspetti igienico-sanitari, che da supporto per la gestione delle attività relative alle segnalazioni pervenute relativamente alla mancanza dei requisiti di accesso;
- Il Dipartimento del Farmaco che svolge attività di vigilanza, controllo e supporto in meritoall’attività di informazione scientifica sui farmaci, presidi e dispositivi;
- La UOC Servizio Prevenzione e Protezione e il Fisico Esperto Qualificato che svolgono attività di vigilanza e controllo rispettivamente per la valutazione dei rischi e per gli aspetti relativi alle radiazioni ionizzanti.
- Al fine di assicurare un costante monitoraggio dell’attività degli Informatori Scientifici delFarmaco, le Aziende farmaceutiche devono comunicare al Dipartimento del Farmaco dell’ASP di Messina, con cadenza annuale, entro il 31 gennaio dell’anno successivo:
- il numero medio annuale di visite effettuate dagli Informatori Scientifici del Farmaco pressogli operatori sanitari che sono stati nell’anno destinatari dell’attività di InformazioneScientifica.
Il Dipartimento del Farmaco, quale struttura deputata al controllo e vigilanza, redige un report trimestrale sulla propria attività di vigilanza, evidenziando tutte le criticità riscontrate e la inviano alla Direzione Aziendale.
Tutte le violazioni al presente provvedimento e quelle relative al D.Lgs. n.541/92 verrannocomunicate, oltre che alle autorità competenti, anche al Servizio 7 “Farmaceutica” – DPS Assessorato della Salute della Regione Siciliana, al Ministero della Salute e all’Agenzia Italiana delFarmaco (AIFA), ognuno per la parte di propria competenza.
É in capo ai Direttori/Responsabili di U.O. la responsabilità della corretta applicazione nella propria U.O. di quanto previsto dal presente Regolamento.
L’ASP di Messina vigila sulla corretta applicazione delle disposizioni contenute nel presente Regolamento attraverso un gruppo di lavoro multiprofessionale che svolgerà controlli interni ed esterni, segnalando al Responsabile della Prevenzione della Corruzione e Trasparenza e alla Direzione Sanitaria eventuali casi di violazione.
Riservatezza delle informazioni
Non è consentito ad alcun operatore sanitario dipendente o convenzionato del SSR fornire agli ISF o agli altri operatori sopracitati informazioni inerenti gli approvvigionamenti, i consumi dei medicinali e le abitudini prescrittive e d’uso dei prodotti prescritti o utilizzati dai medici inerentil’attività in regime SSN.
Analogamente, non è consentito agli operatori sanitari fornire dati personali e/o particolari dei pazienti agli informatori, fatta eccezione per quanto previsto per gli Specialist in base alleistruzioni previste nell’Accordo Quadro stipulato ai sensi dell’art. 28 Regolamento UE 2016/679.
Normativa in materia di prevenzione della corruzione e codice di comportamento
Le Aziende si impegnano a rispettare il Codice di Comportamento aziendale, nonché ilP.T.P.C.T. dell’ASP di Messina, consultabili sul sito aziendale dell’ASP di Messina(www.asp.messina.it) nella sezione “Amministrazione trasparente”, per le parti di competenza.
N.d.R.: Secondo il Decreto Legislativo 196 del 30 giugno 2003 (“Codice della privacy” – Testo unico sulla Privacy della Repubblica italiana), modificato dal Decreto Legislativo 101 del 10 agosto 2018 per “trattamento dei dati” personali si intende qualsiasi operazione effettuata, anche senza l’uso di strumenti elettronici, che riguarda: l’utilizzo, la consultazione, la raccolta, la registrazione, l’organizzazione, conservazione, elaborazione, modifica, estrazione, raffronto, selezione, l’interconnessione, il blocco, la diffusione, la comunicazione, la cancellazione di dati, anche se non registrati in una banca dati.
Gli elenchi degli ISF, la registrazione delle visite, gli orari di controllo, sono dati personali degli ISF. Gli stessi ISF devono dare il consenso scritto alla tenuta dei loro dati, deve essere inoltre indicato chi detiene questi dati ed il responsabile degli stessi. Deve essere inoltre garantita la sicurezza dei dati, non possono quindi essere esposti alla consultazione di chiunque, men che meno ai funzionari delle aziende per le quali lavorano, ciò costituirebbe un controllo improprio di un’attività per conto di altri. Tutti reati.
Gli ISF che non sono figure commerciali sono regolamentati e limitati nella loro attività, tutte le figure commerciali delle aziende farmaceutiche invece hanno libero accesso. Una strategia vincente!
Notizie correlate: Sicilia Circolare ISF-19302-del-4-3-2019





