Dopo 8 anni di assenza, il Ministero della Salute, Direzione generale della digitalizzazione, del sistema informativo sanitario e della statistica, ha pubblicato il 19 ottobre scorso la “Relazione sullo Stato Sanitario del Paese 2017-2021”. La Relazione affronta soprattutto le questioni aperte negli ultimi anni. Come ad esempio la rinuncia alle cure e il nuovo sistema di garanzia dei Livelli essenziali di assistenza (Lea) e funge da strumento organico di valutazione degli obiettivi di salute raggiunti e delle strategie poste in essere per il loro conseguimento. È un risultato indubbiamente positivo che consente di avere una panoramica indispensabile del Ssn per affrontare criticità come le disuguaglianze nell’assistenza” commenta Tonino Aceti, presidente di Salutequità.
Riportiamo integralmente uno stralcio della Relazione.
L’Organizzazione Mondiale della Sanità (OMS) definisce “essenziali” i farmaci che soddisfano i bisogni sanitari 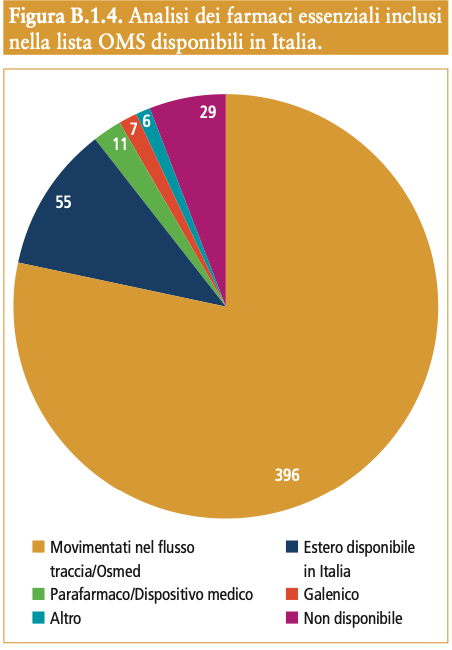 prioritari di una popolazione, selezionati tenendo in debita considerazione la prevalenza della malattia e la rilevanza per la salute pubblica, l’evidenza di efficacia e sicurezza e il rapporto costo- efficacia comparativo, che dovrebbero essere disponibili in forme di dosaggio appropriate, di qualità assicurata e a prezzi accessibili. Dall’analisi effettuata2, oltre il 90% (n. 475) dei farmaci inclusi nella 22a edizione della lista stilata dall’OMS è disponibile in Italia di cui l’80% è intercettato dai Flussi dei dati della farmaceutica (Flusso della tracciabilità e Flusso Osmed), il 12% è rappresentato da farmaci di importazione utilizzati nelle strutture ospedaliere4, il 3% da Parafarmaci e/o Dispositivi Medici e l’1% è rappresentato, rispettivamente, da farmaci galenici e altri5.
prioritari di una popolazione, selezionati tenendo in debita considerazione la prevalenza della malattia e la rilevanza per la salute pubblica, l’evidenza di efficacia e sicurezza e il rapporto costo- efficacia comparativo, che dovrebbero essere disponibili in forme di dosaggio appropriate, di qualità assicurata e a prezzi accessibili. Dall’analisi effettuata2, oltre il 90% (n. 475) dei farmaci inclusi nella 22a edizione della lista stilata dall’OMS è disponibile in Italia di cui l’80% è intercettato dai Flussi dei dati della farmaceutica (Flusso della tracciabilità e Flusso Osmed), il 12% è rappresentato da farmaci di importazione utilizzati nelle strutture ospedaliere4, il 3% da Parafarmaci e/o Dispositivi Medici e l’1% è rappresentato, rispettivamente, da farmaci galenici e altri5.
Sebbene i farmaci inclusi nella lista dell’OMS, comprese le alternative terapeutiche, rap- presentino solo il 30% dei farmaci presenti nell’anagrafica dei farmaci commercializza- ti (conteggio complessivo n. 714 su 2396 ATC di V livello), essi costituiscono il 74% dei consumi totali [in termini di dosi definite giornaliere (defined daily dose, DDD)], a testimonianza del fatto che in Italia sono molto utilizzati, nonostante l’ampia disponibilità di molteplici principi attivi.
Il 97% dei farmaci inclusi nella lista EML (Essential Medicines List) disponibili in Italia è erogato a carico del Servizio sanitario nazionale (SSN), in coerenza con la definizione di farmaco essenziale dell’OMS; il restante 3%6 è rappresentato da dispositivi e/o parafarmaci a carico del cittadino. Negli ultimi 50 anni in Italia la mortalità è nettamente diminuita, l’aspettativa di vita è cresciuta di 1 mese ogni 4 e oggi l’Italia figura ai primi posti al mondo per valore medio dell’aspettativa di vita, anche grazie alla numerosa disponibilità e accessibilità di farmaci e vaccini, i quali contribuiscono quotidianamente al miglioramento della salute dei cittadini.
È stato osservato che il tempo intercorso tra la data della decisione della Commissione Europea e la data di presentazione dell’istanza di P&R da parte dell’azienda farmaceutica è, dal 2018 al 2020, in media da 10 a 12 mesi per i farmaci non generici e da 7 a 12 mesi per i farmaci generici, presentando una forte variabilità nel tempo per entrambe le categorie farmaceutiche.
La durata complessiva del procedimento – dalla data di avvio alla data di conclusione, includendo i tempi di valutazione da parte delle commissioni consultive dell’Agenzia (Segretariato HTA, Commissione Tecnico-Scientifica e Comitato Prezzi e Rimborso) – è diminuita dal 2018 al 2020, passando in media da 9 a 8 mesi per i farmaci non generici. Per quanto concerne il tempo di trasmissione in Gazzetta Ufficiale, dalla data di conclusione del procedimento fino alla trasmissione in Gazzetta Ufficiale del relativo provvedimento, si è osservata una diminuzione nel tempo, passando da poco più di 2 mesi nel 2018 a 2 mesi nel 2020, sia per i farmaci generici sia per i farmaci non generici.
 Lo scopo di riconoscere il requisito di innovazione terapeutica è garantire un accesso omogeneo a livello nazionale, in base all’accordo Stato-Regioni del 18 novembre 2010, per tutti quei farmaci indicati per le aree terapeuti- che nelle quali c’è effettivamente un bisogno clinico importante e/o insoddisfatto. Tale accesso viene garantito mediante l’inserimento di questi farmaci considerati innovativi nei Prontuari Terapeutici Ospedalieri Regionali. Dal punto di vista economico, i farmaci in- novativi beneficiano della sospensione del- le riduzioni di legge del 5%+5%. La Legge di bilancio 2017 (art. 1, commi 397-408, della Legge 232/2016) ha inoltre previsto uno specifico finanziamento per l’acquisto di farmaci innovativi, che si è concretizzato nell’istituzione di due fondi ad hoc: un fon- do dedicato esclusivamente all’acquisto dei medicinali oncologici innovativi, con una dotazione di 500 milioni di euro annui, e un fondo per il concorso al rimborso alle Regio- ni per l’acquisto delle restanti classi di medicinali innovativi.
Lo scopo di riconoscere il requisito di innovazione terapeutica è garantire un accesso omogeneo a livello nazionale, in base all’accordo Stato-Regioni del 18 novembre 2010, per tutti quei farmaci indicati per le aree terapeuti- che nelle quali c’è effettivamente un bisogno clinico importante e/o insoddisfatto. Tale accesso viene garantito mediante l’inserimento di questi farmaci considerati innovativi nei Prontuari Terapeutici Ospedalieri Regionali. Dal punto di vista economico, i farmaci in- novativi beneficiano della sospensione del- le riduzioni di legge del 5%+5%. La Legge di bilancio 2017 (art. 1, commi 397-408, della Legge 232/2016) ha inoltre previsto uno specifico finanziamento per l’acquisto di farmaci innovativi, che si è concretizzato nell’istituzione di due fondi ad hoc: un fon- do dedicato esclusivamente all’acquisto dei medicinali oncologici innovativi, con una dotazione di 500 milioni di euro annui, e un fondo per il concorso al rimborso alle Regio- ni per l’acquisto delle restanti classi di medicinali innovativi.
L’incremento della quota di fondo indistinto 2021 rispetto al 2019, comprensiva delle quote premiali, sommato alle ulteriori risorse messe a disposizione dalle norme nazionali (risorse Covid- 19 2021, accantonamenti Covid-19 2020 da poter utilizzare nel 2021, ulteriore contributo statale per la copertura dei costi Covid-19 derivante dal payback), è stato sostanzialmente sufficiente a coprire gli incrementi dei costi registrati nel medesimo periodo 2019-2021.
Con riferimento, infine, all’anno 2021, dalle risultanze dei dati di IV Trimestre 2021 si evidenzia un generale peggioramento di quasi tutte le Regioni, in particolare della Regione Puglia, che registra un disavanzo prima delle coperture pari a 239 milioni di euro. Lazio: –83,5 mln euro; Abruzzo: 0,7 mln euro; Molise: –60 mln euro; Campania: –69,5 mln euro; Puglia: –239 mln euro; Calabria: +27 mln euro; Sicilia: 0,5 mln euro.
Notizie correlate. Ministero della Salute. Relazione sullo stato sanitario del Paese