
Proprietà intellettuale e innovazione farmaceutica: servono norme certe e coerenti
Oggi più che mai si può dire che l’innovazione e i diritti di proprietà intellettuale che la proteggono e la incoraggiano sono il cuore stesso dello sviluppo del mondo.
filo diritto – 2 dicembre 2019
Probabilmente il punto di svolta di questa evoluzione è rappresentato dal TRIPs Agreement (Agreement on Trade Related Aspects of Intellectual Property Rights), adottato a Marrakech nel 1994  contestualmente all’istituzione del World Trade Organization e con il quale il blocco dei Paesi allora economicamente più progrediti, con in testa gli Stati Uniti, subordinò la liberalizzazione del commercio mondiale proprio al rispetto da parte di tutti i Paesi aderenti al WTO di certi standard di protezione dei diritti di proprietà intellettuale: questi diritti sono infatti il più importante “valore aggiunto” del nostro tempo e dunque un elemento chiave per la competitività delle imprese.
contestualmente all’istituzione del World Trade Organization e con il quale il blocco dei Paesi allora economicamente più progrediti, con in testa gli Stati Uniti, subordinò la liberalizzazione del commercio mondiale proprio al rispetto da parte di tutti i Paesi aderenti al WTO di certi standard di protezione dei diritti di proprietà intellettuale: questi diritti sono infatti il più importante “valore aggiunto” del nostro tempo e dunque un elemento chiave per la competitività delle imprese.
A fare la differenza sono l’efficienza di questa protezione e la coerenza degli istituti posti a tutela della proprietà intellettuale con le altre norme dell’ordinamento, in modo da attribuire alle imprese la possibilità di valorizzare tutte le esternalità positive derivanti dall’uso dei loro diritti, vietando ogni forma di free-riding e di sfruttamento parassitario dei loro investimenti. Mentre però sotto il primo profilo l’Italia è incredibilmente all’avanguardia, grazie a un sistema di Corti specializzate e a norme speciali considerate best practice a livello europeo, sotto il secondo il nostro Paese soffre spesso di una sorta di schizofrenia normativa: da un lato infatti si proclama di voler incoraggiare la ricerca e le imprese innovative, dall’altro si contraddicono le parole con i fatti.
 Emblematica di questa schizofrenia è la disciplina della cosiddetta equivalenza terapeutica, nata nell’ambito del diritto sanitario con l’obiettivo di favorire il contenimento della spesa sanitaria e che consente alle Regioni di mettere a gara in un unico lotto funzionale farmaci basati su principî attivi diversi, purché aventi le stesse indicazioni terapeutiche: senza rendersi conto che anche le norme relative alla spesa del SSN devono essere inquadrate nel contesto della ricerca farmaceutica e quindi rispettare i diritti esclusivi che da questa ricerca – spesso frutto di investimenti rilevantissimi – derivano.
Emblematica di questa schizofrenia è la disciplina della cosiddetta equivalenza terapeutica, nata nell’ambito del diritto sanitario con l’obiettivo di favorire il contenimento della spesa sanitaria e che consente alle Regioni di mettere a gara in un unico lotto funzionale farmaci basati su principî attivi diversi, purché aventi le stesse indicazioni terapeutiche: senza rendersi conto che anche le norme relative alla spesa del SSN devono essere inquadrate nel contesto della ricerca farmaceutica e quindi rispettare i diritti esclusivi che da questa ricerca – spesso frutto di investimenti rilevantissimi – derivano.
A monte della tutela di un diritto di brevetto vi è infatti un’attività di ricerca che nel caso farmaceutico, in particolare, comprende anche tutta l’attività susseguente che sta tra la brevettazione e il momento in cui il prodotto sarà in grado di arrivare sul mercato, il che non è affatto scontato che avvenga.
Un approccio a questa materia che sia effettivo nel garantire la tutela brevettuale che giustamente spetta all’innovatore deve perciò tener conto del fatto che uno stesso problema tecnico può essere risolto in una pluralità di modi diversi, dando luogo a invenzioni e brevetti distinti e che quindi principî attivi diversi, pur indicati per la medesima patologia, non possono essere messi sullo stesso piano: chi ha conseguito un nuovo farmaco o un nuovo procedimento che non rientra nell’ambito brevettuale non può infatti pretendere poi di far avere al suo prodotto la stessa collocazione insieme a quello coperto dall’altrui diritto tutelato nell’ambito della stessa valutazione di “equivalenza terapeutica
Deve quindi essere riservata solo al medico la scelta se prescrivere l’uno o l’altro, senza che sia possibile imporne la sostituibilità fuori dal caso della bioequivalenza, che presuppone l’identità del principio attivo e di regola anche quella delle modalità di somministrazione. In questo senso la logica del sistema brevettuale applicata al settore farmaceutico converge nei risultati con l’esigenza della tutela della sicurezza dei pazienti e della libertà dei medici, ai quali lo switch da un farmaco ad un altro non può essere imposto, se non quando risulti che l’uno può essere indifferentemente assunto al posto dell’altro sulla base di un adeguato supporto scientifico/sperimentale.
Solo in questo modo è possibile configurare un equilibrio tra gli interessi dei diversi attori coinvolti (il titolare del brevetto farmaceutico, i suoi concorrenti, le istituzioni pubbliche, i medici e i pazienti), conforme a un corretto bilanciamento dei diversi diritti di rango costituzionale in gioco e alla funzione che la protezione dell’innovazione nel campo farmaceutico deve svolgere nella realtà economica e nel “mondo della vita”.
Brevetto farmaceutico, il labile confine tra tutela e abuso
Altalex – 20/12/2019 di Agnese Iemma
Secondo una serie di indagini, condotte al livello europeo, attualmente il settore farmaceutico si può considerare uno tra quelli maggiormente sanzionati dall’Autorità Garante della Concorrenza e del Mercato, a causa dell’incessante sviluppo e utilizzo di pratiche strategiche per l’ottenimento della tutela brevettuale, le  quali astrattamente lecite, si pongono in contrasto con il dettato del legislatore in materia di diritti di privativa industriale, ma soprattutto con la normativa antitrust, dal momento in cui il più delle volte vengono utilizzate con fini unicamente escludenti e anticoncorrenziali.
quali astrattamente lecite, si pongono in contrasto con il dettato del legislatore in materia di diritti di privativa industriale, ma soprattutto con la normativa antitrust, dal momento in cui il più delle volte vengono utilizzate con fini unicamente escludenti e anticoncorrenziali.
In una società come quella attuale, dove come si legge anche nella relazione della Commissione Europea del 2009, “l’innovazione costituisce una componente essenziale e dinamica di un’economia di mercato aperta e competitiva”[1]; la tutela brevettuale si pone come una manifestazione del principio della libera iniziativa economica che si sostanzia nella capacità di un’impresa di decidere autonomamente se tutelare o meno la propria attività inventiva, attraverso il riconoscimento di un diritto esclusivo volto a prevenire o inibire l’utilizzo, la produzione, la commercializzazione, ovvero l’importazione di un prodotto, senza il preventivo consenso del titolare del brevetto.
I diritti di proprietà industriale costituiscono una considerevole risorsa aziendale, soprattutto se si guarda al mercato farmaceutico, che rappresenta uno dei settori di maggiore importanza innovativa, a livello globale e si caratterizza per la doppia natura, industriale e terapeutica, del bene commercializzato.
Nonostante tale settore si distingua per il diffuso controllo pubblico, volto ad assicurare, nei limiti della spesa farmaceutica, l’uso appropriato dei farmaci senza mortificare le dinamiche concorrenziali, negli ultimi  vent’anni, è stato il più sanzionato da parte dell’AGCM, che come evidenziato anche dalle inchieste della Commissione Europea del 2009 e del 2019, ha appurato che più del 63% degli accordi conclusi tra case farmaceutiche, fossero da considerare vietati, ex art. 101 TFUE.
vent’anni, è stato il più sanzionato da parte dell’AGCM, che come evidenziato anche dalle inchieste della Commissione Europea del 2009 e del 2019, ha appurato che più del 63% degli accordi conclusi tra case farmaceutiche, fossero da considerare vietati, ex art. 101 TFUE.
Ed infatti, la spasmodica conquista del mercato, ha condotto le Big Pharma ad elaborare nuove strategie di mercato, basate il più delle volte soprattutto sull’uso distorto dei brevetti che hanno reso sempre più arduo il compito di distinguere tra lecito ed illecito, o meglio, tra tutela e abuso.
Abuso che si realizza ogni qualvolta l’esclusiva ottenuta dall’azienda farmaceutica viene utilizzata in modo distorto, al fine di perseguire finalità estranee a quelle espressamente individuate dal legislatore, perdendo così la propria funzione pro-concorrenziale ed acquistando contrariamente, finalità escludente.
La capacità del brevetto di trasformarsi in strumento anticoncorrenziale, non è nota solo al settore farmaceutico ma si riscontra in tutti i settori economici, tuttavia è proprio in questo che desta maggiori preoccupazioni, perchè capace di incidere in modo rilevante, non solo sulle norme che regolano il mercato e la concorrenza, ma più nello specifico, su un diritto fondamentale per la vita umana, come il diritto alla salute.
In tale contesto si colloca il caso Roche/Genentech/Novartis, negli ultimi giorni nuovamente sotto i riflettori, a causa del ciclone che ha investito i vertici dell’Agenzia Italiana del Farmaco, sotto indagine da parte della Corte dei Conti per aver procurato un presunto danno erariale di circa 200 milioni di euro al Servizio Sanitario Nazionale.
Alcuni dirigenti dell’Aifa sono stati, infatti, indagati dalla Corte dei Conti del Lazio, con l’accusa di essere riusciti a limitare negli anni, le prescrizioni del farmaco Avastin a favore del più costoso Lucentis, procurando un danno all’erario, ad oggi quantificato in 200 milioni di euro.
A tal riguardo già il 27 febbraio 2014, l’Antitrsut aveva provveduto a multare per 180 milioni di euro, la Roche e la Novartis, a causa di un cartello che aveva condizionato le vendite dei principali prodotti destinati alla cura della vista.
Secondo l’AGCM, le due aziende si erano accordate per diffondere tra i medici, false notizie al fine di favorire, per la cura delle malattie oftalmiche, la vendita del Lucentis, farmaco coperto dal Sistema Sanitario Nazionale, dal costo indicativo di €900, anziché l’Avastin, di gran lunga più economico, il cui costo si aggira intorno agli €80.
Nel 2004, infatti, la multinazionale Roche, o meglio, la sua controllata Genentech, sviluppava un farmaco antitumorale di nome Bevacizumab, il quale nel 2005 anche senza AIC, tra l’altro mai richiesta, veniva approvato, messo in commercio ed inserito dall’AIFA nell’elenco per il trattamento della degenerazione maculare correlata all’età senile, con il nome di Avastin.
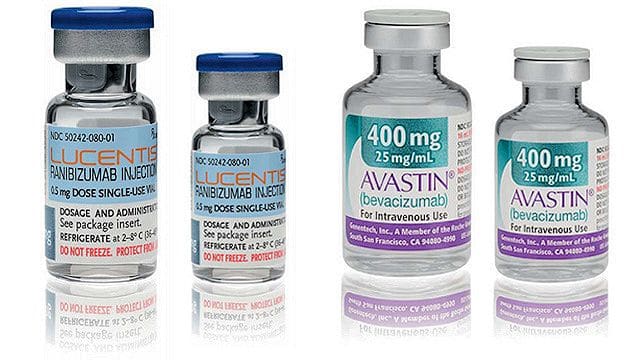 Nel 2007, partendo dal Bevacizumab la stessa Genentech sviluppava poi, un secondo farmaco il Lucentis, incredibilmente più costoso dell’Avastin, il quale però ottenendo l’autorizzazione all’immissione in commercio, AIC, per la cura della degenerazione maculare correlata all’età senile, pian piano sostituiva proprio quest’ultimo nell’elenco dei farmaci erogabili a totale carico del SSN.
Nel 2007, partendo dal Bevacizumab la stessa Genentech sviluppava poi, un secondo farmaco il Lucentis, incredibilmente più costoso dell’Avastin, il quale però ottenendo l’autorizzazione all’immissione in commercio, AIC, per la cura della degenerazione maculare correlata all’età senile, pian piano sostituiva proprio quest’ultimo nell’elenco dei farmaci erogabili a totale carico del SSN.
La mancata richiesta di autorizzazione alla commercializzazione dell’Avastin, portarono però l’Antitrust a ritenere che la strategia adottata dalla Genentech avesse solo ed esclusivamente finalità economiche, al limite di quanto disposto dalla normativa antitrust, generate dall’interconnessione tra Roche, Novartis e Genentech, quest’ultima controllata dalla Roche, a sua volta, per oltre il 30% di proprietà della Novartis.[2]
Da ulteriori indagini emerse poi, che l’estromissione dell’Avastin dall’elenco dei farmaci erogabili a totale carico del SSN, non fu altro che il frutto di un accordo tra le capogruppo Roche e Novartis, volto proprio a sabotare la vendita di quest’ultimo, presentandolo come più pericoloso rispetto al Lucentis e condizionando, in tal modo, i medici, servizi sanitari e maggiormente l’Agenzia Italiana del Farmaco (AIFA).
L’intesa, sviluppatasi a partire da tale strategia di “differenziazione” artificiosa dei due principali farmaci, utilizzati per le medesime patologie, che per l’appunto aveva come unico fine, quello di limitare la prescrizione dell’Avastin e favorire quella del Lucentis, così da trarre maggiori profitti, non poté non essere considerata elusiva del divieto di accordi anticoncorrenziali, ex art. 101 TFUE, da parte della Corte di Giustizia della UE, chiamata in causa dal Consiglio di Stato italiano, in seguito al ricorso di Roche e Novartis, contro la multa di circa 180 milioni di euro inflitta dall’Antitrust.
 Tale pronuncia della Corte di Giustizia della UE alla base delle recentissime indagini svolte dalla Corte dei Conti del Lazio, non può che autorizzare, in attesa degli ulteriori sviluppi alle accuse mosse all’ex direttore generale dell’Aifa e ai componenti della Commissione tecnica scientifica, che decisero sulle “ingiustificate limitazioni alla rimborsabilità” dell’Avastin, una considerazione conclusiva.
Tale pronuncia della Corte di Giustizia della UE alla base delle recentissime indagini svolte dalla Corte dei Conti del Lazio, non può che autorizzare, in attesa degli ulteriori sviluppi alle accuse mosse all’ex direttore generale dell’Aifa e ai componenti della Commissione tecnica scientifica, che decisero sulle “ingiustificate limitazioni alla rimborsabilità” dell’Avastin, una considerazione conclusiva.
“I diritti di proprietà intellettuale”, come si evince dalla già citata relazione della Commissione Europea del 2009,“favoriscono una concorrenza dinamica e incoraggiano le imprese a investire nello sviluppo di prodotti e di processi nuovi o migliorati”, mentre “la concorrenza opera spingendo le imprese a innovare.”
“Per questo motivo sia i diritti di proprietà intellettuale che la concorrenza, sono necessari per promuovere l’innovazione e garantire che essa sia sfruttata in modo concorrenziale” tuttavia non si può negare che una maggiore attenzione alle regole che regolamentano tale stretta interconnessione, tra tutela brevettuale e normativa antitrust, sia da auspicare.
Invero, oggi approfondire la materia della tutela brevettuale farmaceutica, senza trattare nel contempo del diritto antitrust, significa non comprendere fino in fondo l’argomento che si sta affrontando e forse è proprio per questo che negli anni, le imprese farmaceutiche sono riuscite con facilità ad abusare dei propri diritti di privativa.
Il caso Roch/Genentech/Novartis rappresenta, certamente, un esempio della necessità sempre più stringente, di garantire, magari mediante la predisposizione di nuovi strumenti, l’effettiva attuazione delle norme che contribuiscano a tutelare gli imprenditori e la concorrenza, ma più nello specifico i consumatori, ai quali soprattutto in tale settore non può non essere garantito l’acquisto dei farmaci a prezzi competitivi e quindi l’effettivo godimento e tutela del diritto alla salute, di cui all’art. 32 della Carta Costituzionale.
Non è certamente facile affermare con certezza quale possa essere la soluzione che contrasti l’adozione di tali meccanismi escludenti, tuttavia una più severa applicazione delle regole che governano la materia deve ritenersi necessaria.
>> Sulla materia leggi anche Marchio registrato: la guida completa (procedimento, formalità, presupposti e costi per la registrazione).





