
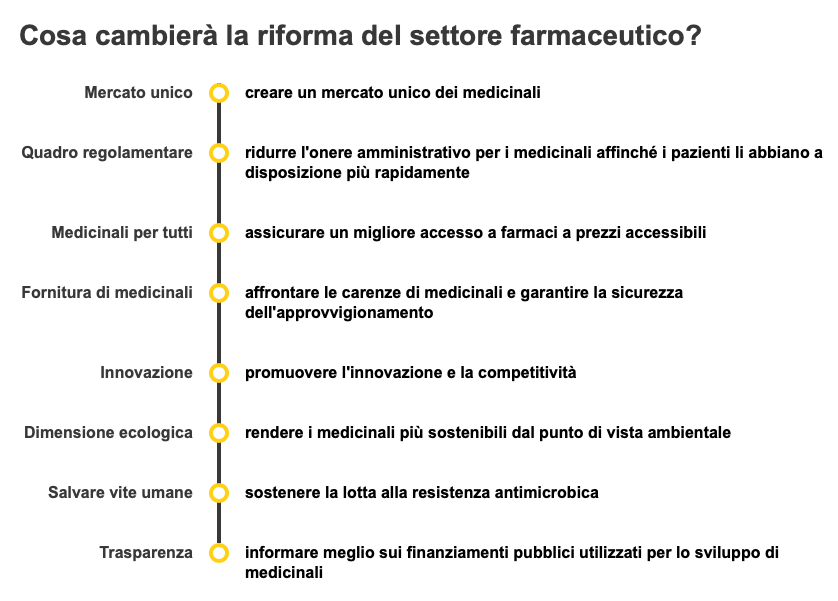
L’accesso ai medicinali varia da un paese all’altro in Europa. Alcuni europei devono attendere in media 4 mesi  per trovare un determinato medicinale nella farmacia più vicina, mentre altri devono aspettare più di 2 anni per lo stesso medicinale.Tutti i pazienti dovrebbero avere lo stesso accesso ai medicinali in Europa, che dovrebbero essere disponibili quando ne hanno bisogno e contemporaneamente in tutti gli Stati membri.
per trovare un determinato medicinale nella farmacia più vicina, mentre altri devono aspettare più di 2 anni per lo stesso medicinale.Tutti i pazienti dovrebbero avere lo stesso accesso ai medicinali in Europa, che dovrebbero essere disponibili quando ne hanno bisogno e contemporaneamente in tutti gli Stati membri.
Sta inoltre aumentando la preoccupazione per le possibili carenze di medicinali, come antibiotici e antidolorifici.
La Commissione europea propone pertanto di modernizzare il settore farmaceutico con un approccio incentrato sul paziente, che sostenga pienamente anche un’industria innovativa e competitiva. Il suo approccio preserverà gli elevati standard dell’UE per l’autorizzazione di medicinali sicuri, efficaci e di qualità.
Promuovere l’innovazione per un’industria farmaceutica competitiva
L’obiettivo dell’UE è offrire un ambiente attraente e favorevole all’innovazione per la ricerca, lo sviluppo e la produzione di medicinali in Europa. L’UE creerà questo ambiente promuovendo un’innovazione di livello mondiale, governata da norme stabili e coerenti che tengano il passo con l’innovazione e aumentino la competitività, riducendo nel contempo la burocrazia e i costi.
Cercherà di garantire un’autorizzazione più rapida dei medicinali innovativi attraverso l’attuazione di norme e procedure più semplici e un maggiore coinvolgimento dei pazienti nei processi di valutazione dei farmaci senza compromettere la sicurezza.
In termini di ricerca e sviluppo per le esigenze mediche insoddisfatte, l’innovazione a vantaggio dei pazienti sarà ricompensata attraverso un sistema di incentivi competitivi a livello mondiale
 Stella Kyriakides, Commissaria Europea alla Salute, afferma, in una intervista ad Aboutpharma, che con questa riforma non si vuole ridurre la tutela della proprietà intellettuale, ma rimodularla. E ciò avviene attraverso un sistema premiale fatto di incentivi cumulabili.
Stella Kyriakides, Commissaria Europea alla Salute, afferma, in una intervista ad Aboutpharma, che con questa riforma non si vuole ridurre la tutela della proprietà intellettuale, ma rimodularla. E ciò avviene attraverso un sistema premiale fatto di incentivi cumulabili.
Una delle questioni più controverse è la durata del brevetto di un farmaco. Secondo la riforma, oltre al periodo minimo di tutela di otto anni di esclusiva di mercato di cui disporranno le imprese che commercializzano medicinali innovativi, si possono ottenere ulteriori periodi di protezione a condizione che il farmaco sia distribuito in tutti gli Stati Ue (+2 anni), che risponda a un’esigenza medica insoddisfatta (+6 mesi), che siano svolte sperimentazioni cliniche comparative (+6 mesi) o se è in grado di curare anche altre malattie (+1 anno).
Insomma, se tutte le condizioni che rispondono a obiettivi di salute pubblica sono soddisfatte, si può arrivare a 12 anni complessivi di tutela; una situazione non solo superiore al regime attuale, ma anche tra le più generose al mondo. Le PMI potranno avere tempi più lunghi per essere presenti in tutti i mercati degli Stati Ue, e avranno la possibilità di far leva su un sostegno dedicato di tipo regolatorio e scientifico da parte dell’Ema
Per le aziende è un obiettivo irrealistico.
I produttori dei generici potranno avviare la procedura di autorizzazione da parte dell’Ema prima ancora della scadenza dell’esclusiva di mercato, in modo da esser pronti alla commercializzazione già all’indomani del via libera. Il che contribuisce all’obiettivo della convenienza economica
La Commissaria osserva che oggi ci vogliono, in media, 400 giorni tra la presentazione della domanda all’Ema e l’autorizzazione all’immissione in commercio per un nuovo farmaco. La pandemia ci ha dimostrato, invece, che le procedure possono essere velocizzate, senza compromettere in alcun modo la sicurezza.
Per questo la riforma prevede che il tempo a disposizione dell’Agenzia europea del farmaco passi da 210 a 180 giorni, e quello per la Commissione per dare l’ok alla commercializzazione da 67 a 46 giorni. Ciò consentirà alle terapie di raggiungere gli scaffali più velocemente.
(Fonte: Commissione Europea, Aboutpharma)
Notizie correlate:
Farmindustria. Comunicato stampa su revisione legislazione farmaceutica europea
 La revisione della legislazione farmaceutica europea presentata oggi dalla Commissione UE, se approvata, avrà conseguenze pesantissime sulla competitività e sull’attrattività dell’industria farmaceutica in Europa e in Italia, quindi sugli investimenti e sull’occupazione. Ma non solo: gli effetti potranno tradursi anche in un minore accesso alle cure e all’innovazione per i cittadini.
La revisione della legislazione farmaceutica europea presentata oggi dalla Commissione UE, se approvata, avrà conseguenze pesantissime sulla competitività e sull’attrattività dell’industria farmaceutica in Europa e in Italia, quindi sugli investimenti e sull’occupazione. Ma non solo: gli effetti potranno tradursi anche in un minore accesso alle cure e all’innovazione per i cittadini.
L’indebolimento della proprietà intellettuale – con la riduzione della data protection da 8 a 6 anni e dell’esclusiva di mercato per i farmaci orfani da 10 a 9 – ha rischi certi per investimenti e innovazione, assolutamente non compensati dal nuovo sistema di incentivi, assai complicato da attivare e dai risultati incerti per le aziende. La proprietà intellettuale non può essere ridotta neanche di un giorno, altrimenti il pericolo è di vedere arrivare prima i nuovi farmaci e vaccini nei Paesi che garantiscono un quadro più favorevole.
A tutto vantaggio dei Paesi extra UE che hanno adottato politiche fortemente incentivanti negli ultimi 20 anni, mentre l’Europa nello stesso periodo ha perso un quarto degli investimenti in ricerca.
Perdita che pesa proprio sugli Stati con più alta presenza industriale, come l’Italia.
In gioco, come ha sottolineato il Governo italiano, c’è un’industria che rappresenta un patrimonio per la salute, la crescita economica, l’innovazione e la stessa sicurezza nazionale, che rischia di essere cancellato di colpo.
N.d.R.: Il comunicato di Farmindustria è del 26 aprile 2023, la nota della Commissione Europea è del luglio 2023
L‘EFPIA, le sue aziende associate e la Commissione Europea condividono gli obiettivi di aumentare l’accesso  dei pazienti ai farmaci in tutta Europa e rafforzare la competitività del settore farmaceutico europeo. Tuttavia, la legislazione proposta così come attualmente definita avrà l’effetto opposto. L’impatto netto delle proposte sarà quello di danneggiare l’innovazione e minare ulteriormente la competitività dell’Europa.
dei pazienti ai farmaci in tutta Europa e rafforzare la competitività del settore farmaceutico europeo. Tuttavia, la legislazione proposta così come attualmente definita avrà l’effetto opposto. L’impatto netto delle proposte sarà quello di danneggiare l’innovazione e minare ulteriormente la competitività dell’Europa.
La legislazione proposta inizia a evolvere il sistema normativo europeo, che non è stato ampiamente modernizzato negli ultimi vent’anni ed è sempre più lento rispetto agli Stati Uniti e ad altre regioni leader. Tuttavia, riduce significativamente i diritti di proprietà intellettuale (PI) europei aggiungendo al contempo complessi incentivi per un’ulteriore protezione della PI che in pratica rende impossibile ottenere questi incentivi.
In realtà, le proposte accelereranno diverse tendenze negative, tra cui il calo relativo del 25% della R&S europea e la riduzione della quota globale europea di sperimentazioni cliniche dal 25% al 19%. I dati annuali pubblicati oggi dall’EFPIA mostrano che la crescita della spesa in R&S in Cina è stata più di tre volte superiore a quella dell’Europa tra il 2018 e il 2022.
L’affermazione secondo cui le proposte miglioreranno l’accessibilità di farmaci e vaccini promuovendo al contempo la ricerca scientifica e l’innovazione in Europa è fuorviante. Le proposte mettono a repentaglio i progressi nell’assistenza a tutte le persone, da coloro che vivono con le condizioni croniche più comuni a coloro che soffrono di malattie ultra rare poco conosciute. La comunità dell’innovazione, dalle grandi aziende farmaceutiche basate sulla ricerca alle biotecnologie, ha ripetutamente avvertito che le proposte accelereranno ulteriormente la perdita della base industriale dell’Europa a favore degli Stati Uniti e dell’Asia, e gli europei perderanno i progressi che saranno disponibili altrove.
L’industria europea (EFPIA) chiede le seguenti modifiche ai progetti proposti:
- Realizzare lo scopo principale della legislazione farmaceutica europea ottimizzando ulteriormente il quadro normativo e garantendo il massimo utilizzo di percorsi accelerati a sostegno delle esigenze dei pazienti.
- In linea con le conclusioni del Consiglio europeo (marzo 2023), rafforzare, piuttosto che ridurre, la linea di base del PSR (Payment Systems Regulator) e l’esclusività del mercato dei farmaci orfani della regione, nonché creare incentivi separati per guidare l’innovazione e affrontare le sfide dell’assistenza sanitaria.
- Affrontare congiuntamente le barriere e i ritardi nell’accesso a nuovi trattamenti sulla base di una comprensione condivisa delle prove generate dal portale Industry European Access Hurdles, pubblicato di recente.
- Includere un’ampia definizione di bisogno medico insoddisfatto (UNM) incentrata sul paziente che incentivi percorsi di ricerca per soddisfare i bisogni delle persone che vivono con malattie rare e condizioni croniche e valorizzi adeguatamente l’innovazione incrementale.
- Garantire che i requisiti ambientali e della catena di approvvigionamento siano proporzionati e adatti allo scopo, per supportare al meglio i nostri obiettivi condivisi di aumentare la fornitura di farmaci e ridurre l’impatto ambientale del nostro settore.
Notizie correlate: Proposal for a REGULATION OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL
ANNEXES to the proposal for a Regulation of the European Parliament and of the Council





